
科目: 来源: 题型:填空题
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的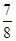 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) H2O(g) ΔH="+44.0" kJ/mol
H2O(g) ΔH="+44.0" kJ/mol 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。查看答案和解析>>
科目: 来源: 题型:填空题
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。请回答:
(1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2=CH3OH。则H2与CO反应生成CH3OH的热化学方程式为: 。
(2)如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从 口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为: ________________
③假设使用的“燃料”是水煤气(成分为CO、H2)用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为 。
查看答案和解析>>
科目: 来源: 题型:填空题
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:填空题
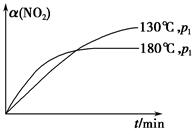
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目: 来源: 题型:填空题
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。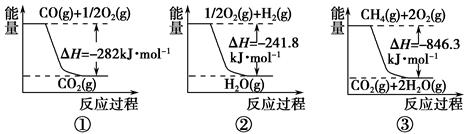
反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
查看答案和解析>>
科目: 来源: 题型:填空题
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+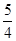 O2(g)===
O2(g)===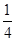 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能
(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH=________。
查看答案和解析>>
科目: 来源: 题型:填空题
(1)(广东)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)===3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)===6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)===P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)===CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64.39 kJ·mol-1
②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196.46 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:填空题
保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示: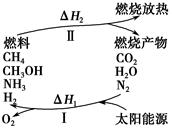
过程Ⅰ可用如下反应表示:
①2CO2 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O 4NH3+3O2 ④2CO2+4H2O
4NH3+3O2 ④2CO2+4H2O 2CH3OH+3O2 ⑤2CO+4H2O
2CH3OH+3O2 ⑤2CO+4H2O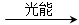 ________+3O2
________+3O2
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)请完成第⑤个反应的化学方程式:____________________。
(3)上述转化过程中,ΔH1和ΔH2的关系是________。
(4)断裂1 mol化学键所需的能量见下表:
| 共价键 | H—N | H—O | N≡N | O===O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
查看答案和解析>>
科目: 来源: 题型:填空题
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)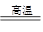 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_______________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。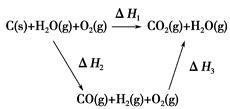
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)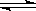 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)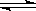 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com