
科目: 来源: 题型:填空题
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标况),实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目: 来源: 题型:填空题
(共11分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为: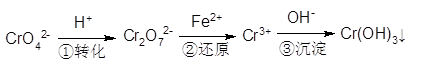
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O2- 7和CrO2- 7的浓度相同 B.2v(Cr2O2- 7)=v(CrO2- 4) C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)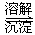 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(用电极反应式解释) 。溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目: 来源: 题型:填空题
常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |

查看答案和解析>>
科目: 来源: 题型:填空题
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 >
> ,则该反应是 热反应。
,则该反应是 热反应。
查看答案和解析>>
科目: 来源: 题型:填空题
(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
| 温度/℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目: 来源: 题型:填空题
已知A(g)+B(g)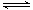 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
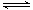 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。查看答案和解析>>
科目: 来源: 题型:填空题
(12分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L?min);乙v(Y)=2mol/(L?min);丙v(Z)=4.5mol/(L?min);丁v(X)=0.075mol/(L?s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不")移动;若向
达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不")移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的
平衡中的X的转化率相比较 。
| A.无法确定 | B.⑷一定大于⑴ | C.⑷一定等于⑴ | D.⑷一定小于⑴ |
查看答案和解析>>
科目: 来源: 题型:填空题
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH是最重要的研究方向之一。在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。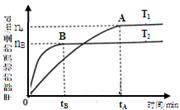
①通过分析上图,可以得出对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填
序号) 。
| A.该反应为放热反应 |
| B.T1时的反应速率大于T2时的反应速率 |
| C.该反应在T1时的平衡常数比T2时的大 |
| D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大 |
查看答案和解析>>
科目: 来源: 题型:填空题
(1)在密闭容器中进行下列反应:M(g) + N(g)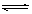 R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。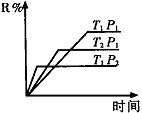
①T1 T2 ,正反应的△H 0。(填“>”、“<”或“=”,下同)。
②P1 P2 , L为 。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g) 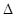 H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。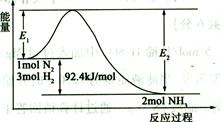
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量 92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是 (填字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
查看答案和解析>>
科目: 来源: 题型:填空题
(14分)某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
| 实验 序号 | 温度/℃ | 时间/min | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com