
科目: 来源: 题型:填空题
在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO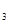 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO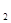 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
查看答案和解析>>
科目: 来源: 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42-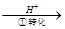 Cr2O72-
Cr2O72-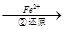 Cr3+
Cr3+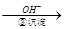 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黄色)+2H+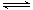 Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 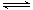 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
查看答案和解析>>
科目: 来源: 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g) +H2O (g) H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
回答下列问题
(1)该反应的平衡常数表达式K= ,ΔH= 0(填“<”、“>”、“=”)
(2)已在一定温度下,C(s) +CO2 (g) 2CO (g)平衡常数K1;
2CO (g)平衡常数K1;
C (s) +H2O(g) CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时间后反应达到平衡,此时CO的转化率为 :若保持其他条件不变,向平衡体系中再通入0. 10molCO和0.40molCO2,此时v正 v逆 (填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:填空题
某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析: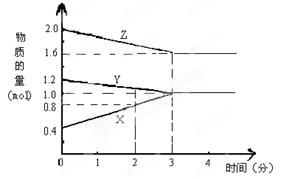
(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率为 ;
(3)该反应是由 开始反应的。(?正反应?逆反应?正逆反应同时。)
查看答案和解析>>
科目: 来源: 题型:填空题
在下列事实中,什么因素影响了化学反应的速率?
(1)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体。 。
(2)同浓度、同体积的盐酸中放入同样大小的锌粒和镁条,产生气体有快有慢。 。
(3)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同。 。
(4)工业上常将固体燃料粉碎进行燃烧。 。
(5)夏天的食品易霉变,冬天就不易发生该现象。 。
查看答案和解析>>
科目: 来源: 题型:填空题
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
查看答案和解析>>
科目: 来源: 题型:填空题
(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 ;
(2)检验溶液B中是否存在Fe3+的方法是 ;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 ;
(Ⅱ)(1) 常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | 氨水物质的量浓度 (mol·L-1) | 盐酸物质的量浓度 (mol·L-1) | 混合溶液 pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目: 来源: 题型:填空题
请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是____ 硝酸(填“浓”或“稀”),相应的离子方程式是 。
(2) 800℃时,在2 L的恒容密闭容器中充入2 mol NO和1mol O2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
①5 min内 v(O2)= 。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO21mol,此时v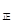 v
v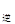 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入1mol NO2,平衡向____ (填“正向”、“逆向”或“不”)移动。达新平衡时,NO2的体积分数____ (填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO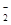 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
查看答案和解析>>
科目: 来源: 题型:填空题
用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题: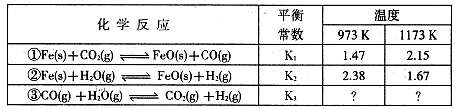
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示: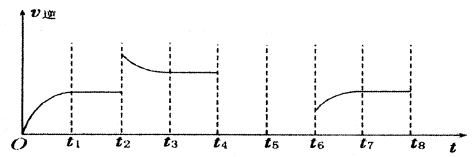
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目: 来源: 题型:填空题
碘及其化合物在生产、生活中具有广泛的用途。解答下列与碘元素有关的试题:
(1)碘是人体中的微量元素之一,是一种智力元素。国家推广“加碘食盐”,其中一般加入的是KIO3,而不是KI。其原因是 。
(2)常温下,NH4I是一种固体,一定温度下在密闭容器中发生下面的反应:
① NH4I(s) 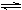 NH3(g) + HI(g)
NH3(g) + HI(g)
② 2HI(g) 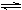 H2(g) + I2(g)
H2(g) + I2(g)
达到平衡时,缩小容器体积,增大体系压强,混合气体的颜色 (填“加深”或“变浅”或“不变”);达到平衡时,反应②的化学平衡常数表达式为 ;达到平衡时c(H2)=0.5mol/L,反应①的化学平衡常数为20,则 c (HI) = 。
(3)如图,在粗试管中加入饱和的KI溶液,然后再加入苯,插入两根石墨电极,接通直流电源。连接电源负极的电极为 极,电极反应式为 。通电一段时间后,断开电源,振荡试管,上层溶液为 色。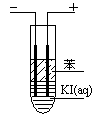
(4)已知Ksp(PbI2)=7.1×10-9mol3/L3。在盛有澄清的PbI2饱和溶液的试管中,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色浑浊产生,这些黄色浑浊的成分是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com