
科目: 来源: 题型:填空题
(创新预测题)已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与
时间t的关系如图所示。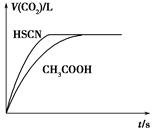
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)______c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。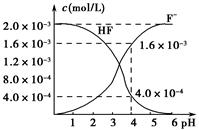
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
某温度(t ℃)时,水的离子积为KW=1.0×10-13mol2·
L-2,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是
____________________________________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是____________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90 ℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液:________;NH4Cl溶液:________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),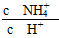 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:填空题
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 ( )。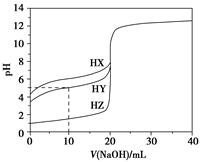
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时c(H+)=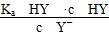 +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:填空题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目: 来源: 题型:填空题
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
④0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
下列关于上述四种溶液的说法不正确的是 ( )
A.溶液②中存在水解平衡:HA-+H2O H2A+OH-
H2A+OH-
B.溶液③中有:c(HA-)+c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)大小:③>①>②>④
查看答案和解析>>
科目: 来源: 题型:填空题
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液呈________(填“酸性”、“中性”或“碱性”),醋酸体积________氢氧化钠溶液体积(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:填空题
在a mL醋酸溶液中滴加0.01 mol·L-1的氢氧化钠溶液,滴定曲线如图所示。
(1)醋酸溶液浓度________(填“大于”“小于”或“等于”)0.01 mol·L-1,理由是________;
(2)b点,c(Na+)________c(CH3COO-)(填“>”“<”或“=”)
(3)当醋酸与氢氧化钠溶液恰好完全中和时,曲线上对应的点Q应在____;
A.2与a之间 B.a与b之间
C.b与c之间 D.a与c之间
(4)下列关系式一定正确的是________。
A.a点,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c点,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:填空题
某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是______________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
| A.c(H+)·c(OH-)=1×10-14 mol·L-1 |
| B.c(Na+)+c(K+)=c(HA-)+2c(A2-) |
| C.c(Na+)>c(K+) |
| D.c(Na+)+c(K+)=0.05 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com