
科目: 来源: 题型:实验题
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下: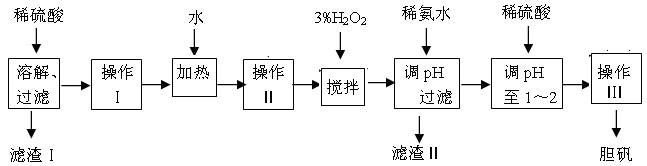
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
查看答案和解析>>
科目: 来源: 题型:实验题
草酸合铁(Ⅲ)酸钾晶体Kx[Fey(C2O4)z]·nH2O可用于摄影和蓝色印刷。为确定其组成,某化学兴趣小组在没有氧气干扰下进行如下实验:
实验Ⅰ.草酸根含量的测定
称取0.9820 g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358 K,用0.2000
mol/LKMnO4溶液滴定,滴定过程中草酸根离子转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4溶液12.00 ml。
实验Ⅱ.铁含量的测定
将上述滴定过草酸根的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液做指示剂,用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液8.00 ml。(已知:实验Ⅱ中涉及的部分离子方程式为:I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题
(1)实验Ⅰ在滴定过程中反应的离子方程式为 。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。若实验Ⅱ中没有对实验Ⅰ的保留液进
行充分加热,则测定的Fe3+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)实验Ⅱ用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:实验题
酸碱中和滴定是应用最多的滴定。现在以酚酞为指示剂,用已知浓度的NaOH溶液去滴定一定体积、未知浓度的HCl溶液。
(1)在滴定中,若实验操作不当会导致实验误差。下列操作会使实验结果偏高的是 。
①酸式滴定管洗涤后没有用待测液润洗
②碱式滴定管洗涤后没有用标准液润洗
③在滴定过程中,向锥形瓶中添加蒸馏水
④待测液从锥形瓶中溅出
⑤滴定过程中起始读数时俯视,终点后读数时仰视
(2)在滴定管使用时首先应该进行的操作是_______________________,滴定过程中左手控制滴定管,右手旋摇锥形瓶,眼睛注视锥形瓶中溶液颜色变化,达到滴定终点的现象是:______________________。
查看答案和解析>>
科目: 来源: 题型:实验题
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。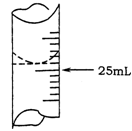
(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目: 来源: 题型:实验题
碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1和V2表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:实验题
滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目: 来源: 题型:实验题
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) → 2AlCl3 + 3H2。
完成下列填空:
(1)写出B处烧瓶中发生反应的化学方程式:_______________________________________。
(2)C中盛有的试剂为__________。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3) 用粗短导管连接D、E的目的是_________(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
E瓶的作用是_______________________________________________________。
(4)F中盛有碱石灰,其目的是_________(选填序号)。
a. 吸收HCl b. 吸收Cl2 c. 吸收CO2 d. 吸收H2O
(5)①将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_____________________________________________。
②若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3。事实证明这样做比较危险,请简述理由 _________________________。
查看答案和解析>>
科目: 来源: 题型:实验题
某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
科目: 来源: 题型:实验题
类比是一种重要的科学研究方法。某化学实验小组类比AgOH能溶于氨水的性质,猜测Cu(OH)2也具有同样的性质,并对此进行实验探究:
(1)写出AgOH与氨水反应的离子方程式_____________________________________。
(2)甲组同学进行如下操作:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成;继续滴加,观察现象,由此得出Cu(OH)2可溶于氨水的结论。
①写出生成蓝色沉淀的离子方程式:_______________________________________________
②写出向沉淀中滴加氨水的实验现象:______________________________________________
(3)乙组同学向CuSO4溶液中滴加NaOH溶液,制得Cu(OH)2悬浊液A,向其中加入足量氨水,始终未观察到(2)中的现象。甲乙两组同学在对他们的实验及现象进行比对后,决定对Cu(OH)2与氨水反应的机理进行探究:
①该实验小组的同学取一定量上述制得的Cu(OH)2悬浊液A,向其中加入足量饱和NH4Cl溶液,结果观察到(2)中现象。据此,有同学认为由于饱和NH4Cl溶液的加入引入了Cl—,致使Cu(OH)2与氨水的反应得以发生,而指导老师表示这一观点是不成立的。为了排除Cl—的干扰,该组同学又做了如下实验:取一定量上述制得的Cu(OH)2悬浊液A,向其中加入饱和___________溶液(填化学式),结果同样观察到(2)中的现象,据此可知该反应的发生与Cl—无关。
②因此,同学们又提出:Cu(OH)2与氨水的反应的发生需要NH4+的参与,于是同学们进一步探究:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成。通过离心的方法得到Cu(OH)2沉淀。将沉淀洗涤后,置于干燥洁净的试管中,向试管中滴加足量饱和氨水,为观察到(2)中现象,再向试管中滴加足量饱和NH4Cl溶液,观察到(2)中现象。
(i)检验是否沉淀洗涤干净的操作是___________________________________________
(ii)据此,可以得出结论:在Cu(OH)2与氨水的反应中,NH4+起着至关重要的作用,且________________对反应的发生有影响。
(4)试从溶解平衡角度解释上述反应发生过程中NH4+的作用:___________________________。
查看答案和解析>>
科目: 来源: 题型:实验题
从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:①准确称取5. 550g样品溶于水,配成l00mL溶液。②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 580g。③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg( OH)2的Ksp ="6.4" xl0-12,当溶液中c(Mg2+)≤1.0×10 -5mol·L-1可视为沉淀完全,则应保持溶液中c(OH-)≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com