
科目: 来源: 题型:问答题
(9分)下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
请回答下列问题: 
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为: 。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置
(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料: 。当反应中收集到标准状况下224mL气体时,消耗的电极质量为 g。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入 极(填a或b,下同),电子从 极流出,电解质溶液中OH-向 极移动。
查看答案和解析>>
科目: 来源: 题型:问答题
(8分)请用相关知识回答下列问题:
(1)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程测得的CO2气体体积随时间变化如右图所示。
①________段化学反应速率最快,_______段收集的二氧化碳气体最多。
②除加入蒸馏水外,当加入下列物质中的 (填序号)时,则能够减缓上述反应的速率。
A.醋酸钠溶液 B.碳酸钙粉末 C.稀硫酸 D.浓盐酸
(2)原电池是一种能量装置。
①下列在理论上可用来设计原电池的反应是 (填序号)。
A.NaOH +HCl==NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
C.CuSO4 +2NaOH== Cu(OH)2+NaSO4 D.C2H6O +3O2==3H2O+2CO2
②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,可以发现产生氢气速率明显加快,其原因是 。
查看答案和解析>>
科目: 来源: 题型:问答题
Ⅰ:某课外活动小组用如图装置进行实验,试回答下列问题。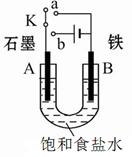
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是_____________(用“>”表示)。
查看答案和解析>>
科目: 来源: 题型:问答题
(10分)某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目: 来源: 题型:问答题
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:问答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
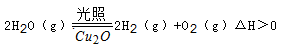
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目: 来源: 题型:问答题
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为: 。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 ;下列物质可用做电池熔融碳酸盐的是 。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式 。
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)= 。
④已知:H2S的电离平衡常数:K1=9.1×10-8、K2=1.1×10-12;H2CO3的电离平衡常数:K1=4.31×10-7、K2=5.61×10-11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为:CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:问答题
某课外活动小组同学用如图装置进行实验,试回答下列问题。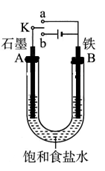
(1)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 ,有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(2)上述实验反应一小段时间后,再把开关K与a连接,则B极的电极反应式为 。
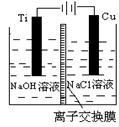
(3)该小组同学认为如果模拟工业上离子交换膜法制烧碱的方法,则可以设想用如下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。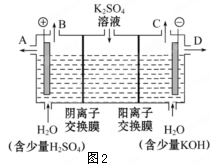
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填”大于”或”小于”或”等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
⑤燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。液态肼(分子式N2H4)可以在氟气中燃烧生成氮气和氟化氢。利用肼、氟气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式? ? 。
查看答案和解析>>
科目: 来源: 题型:问答题
(14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是
造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
①该反应平衡常数表达式____________________________
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:_____________________。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mLlmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).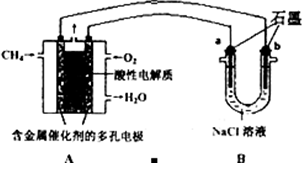
①甲烷燃料电池的负极反应式:______________________________________.
②电解后溶液的pH=____(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是________L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com