
科目: 来源: 题型:实验题
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。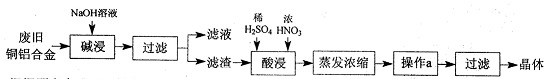
根据题意完成下列填空:
(1)“碱浸”的目的是 ,写出有关的离子方程式 。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有 。
(3)操作a的名称为 ,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为 。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为 ;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式 。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点 。
查看答案和解析>>
科目: 来源: 题型:实验题
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
(1)用NaCl做原料可以得到多种产品。
① 工业上由NaCl制备金属钠的化学方程式是_______________________________。
②电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:____________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:
卤水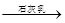 Mg(OH)2
Mg(OH)2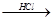 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下: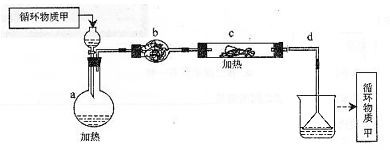
①上图中,装置a由 、 、双孔塞和导管组成。
②循环物质甲的名称是 。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是 。
④装置b中填充的物质可能是 。
查看答案和解析>>
科目: 来源: 题型:实验题
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
[规格]每片含琥珀酸亚铁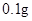 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 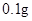 /日,成人治疗量 /日,成人治疗量 — — /日。 /日。小儿用量预防量 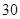 — — /日,治疗量 /日,治疗量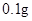 — —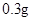 /日 /日[贮藏]避光、密封、在干燥处保存。 |

查看答案和解析>>
科目: 来源: 题型:实验题
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 。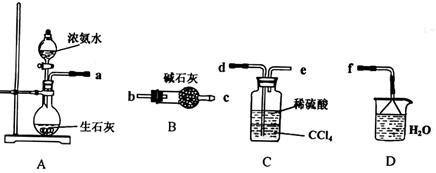
(2)将装置C中两种液体分离开的操作名称是_________。装置D的作用是 。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是: 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“不受影响”、“偏低”或“偏高”),原因是 。
查看答案和解析>>
科目: 来源: 题型:实验题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe的氧化物和SiO2,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: 
试回答下列问题:
(1)B物质的化学式是 在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |

查看答案和解析>>
科目: 来源: 题型:实验题
现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母): 。
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
| | 读数次数 | 质量/g |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目: 来源: 题型:实验题
(1)下列实验操作或对实验事实的描述不正确的有 (填序号)。
| A.用托盘天平称量17.55g氯化钠晶体 |
| B.碳酸钠溶液保存在带玻璃塞的试剂瓶 |
| C.用干燥的pH试纸测定新制氯水的pH |
| D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大 |
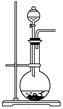


| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | | | 浓氨水 |
| 圆底烧瓶中试剂 | | KMnO4 | |
查看答案和解析>>
科目: 来源: 题型:实验题
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
⑴写出下列仪器的名称:
①____________;②_____________;④__________;
⑵仪器①~④中,使用时必须检查是否漏水的有______。(填序号)
⑶若利用装置I分离四氯化碳和乙醇的混合物,还缺少的仪器是_________,将仪器补充完整后进行的实验操作的名称为_____________ 。现需配制250 mL 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______________、_________________ 。
查看答案和解析>>
科目: 来源: 题型:实验题
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。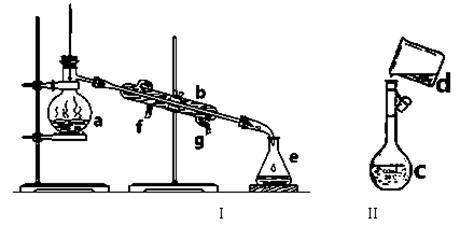
⑴写出下列仪器的名称:a. b. c.
⑵仪器a~c中,使用前必须检查是否漏水的有 。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,
将仪器补充完后进行实验,温度计水银球的位置在 处。
冷凝水由 (填f或g)口通入。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有: 。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
查看答案和解析>>
科目: 来源: 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
已知:几种化合物的溶解度(S)随温度(T)变化曲线如下图所示。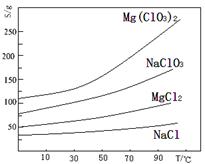
(1)过滤时主要玻璃仪器有 。加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是: 。
(3)“调节pH=4”可选用的试剂是 (填编号)
①MgO ②CuO ③稀NaOH溶液
④Mg ⑤稀硫酸 ⑥MgCO3
(4)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+。记录消耗K2Cr2O7溶液的体积。
①步骤2中发生反应的离子方程式为: 。
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则产品中Mg(ClO3)2·6H2O的含量会 。(填“偏高”、“偏低” 或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com