
科目: 来源: 题型:填空题
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下: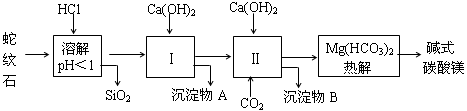
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |

查看答案和解析>>
科目: 来源: 题型:填空题
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 。
①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因 。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是 。
查看答案和解析>>
科目: 来源: 题型:填空题
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作1的名称为 。操作2用到的玻璃仪器有烧杯和
(2)“浸出”步骤中,为提高铜的浸出率,可采取的措施有
(3)比较操作2之前与操作3之后的溶液,说明两步骤主要目的是 。
(4)取少量所得溶液A,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)(不考虑除注明外的其它杂质干扰)
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL.
滴定反应:Cu2+ + H2Y2– CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
A.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
B.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
C.滴定前,滴定管尖端有气泡,滴定后气泡消失
查看答案和解析>>
科目: 来源: 题型:填空题
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:
查资料得知:
| 物质名称 | 溶度积(Ksp) | pH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
查看答案和解析>>
科目: 来源: 题型:填空题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应l”反应速率的措施有________________________(写出一条即可)。
(2)“反应2”的氧化剂是_____________,该反应的化学方程式为__________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从“母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目: 来源: 题型:填空题
钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要流程如下:
已知:①焙烧时可发生反应:V2O5 + Al2O3+2Na2CO3 2NaVO3 +2NaAlO2 +2CO2
2NaVO3 +2NaAlO2 +2CO2
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g /100g水
(1)“浸出渣B”的主要成分是 。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是 。
(3)“操作①”包括 、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是 。(填序号)



A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
| A.BaCl2 | B.BaCO3 |
| C.NaOH | D.Ba(OH)2 |
查看答案和解析>>
科目: 来源: 题型:填空题
废钒催化剂的主要成分是V2O5、VOSO4、K2SO4、SiO2和Fe2O3等,现欲利用以下工艺流程回收V2O5。
回答下列问题:
(1) VOSO4中,V元素的化合价为_______,①中产生的废渣的主要成分是_________。
(2)配平④中反应的离子方程式:
(3)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表: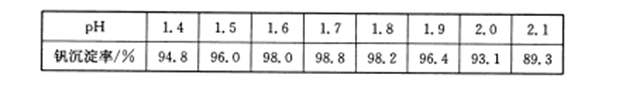
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为______________。
(4)生产时,将②中的酸性萃余液循环用于①中的水浸。在整个工艺流程中,可循环利用的物质还有________________。
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:______________________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,无沉淀生成。
第二步:继续加入过量的稀硫酸,有白色沉淀生成。
第三步:过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,
在此过程中溶液沉淀量的变化如右图所示,加热该溶液,
可产生使湿润的红色石蕊试纸变蓝色的气体。
根据以上实验现象回答下列问题:
(1)该待测液中一定含有 离子,一定没有 离子,可能有 离子。
(2)某同学采用测pH的方法来判断滴入NaOH溶液后是否使溶液呈碱性,该实验操作是 。
(3)第三步中产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为 ,该步骤中预
期会出现另外一个特殊的实验现象,该现象对应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:填空题
为提纯含NaCl和Na2SO4两种杂质的NaNO3溶液,且逐一分离出杂质,某同学设计了如下的实验流程:
(1)操作①②③的名称都是________(填操作名称)。
(2)写出试剂的名称:试剂1___________;试剂2_____________。
(3)操作③之前加入Na2CO3的目的是________________________。
(4)加入试剂4后,发生反应的离子方程式为_________________。
控制试剂4的加入量“适量”的方法是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com