
科目: 来源: 题型:填空题
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 ? 2H2O,工艺流程如下: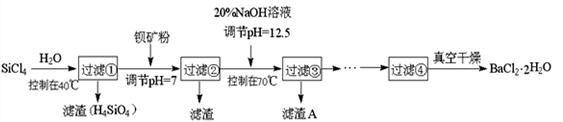
已知: ① 常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197; BaCl2 ? 2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式__________________________________
(2)高温下,SiCl4 (g) 用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收
59 kJ热量,则该反应的热化学方程式为__________________________________
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2 ②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2 ? 2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 ? 2H2O___________吨。
查看答案和解析>>
科目: 来源: 题型:填空题
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: ① NaBr+H2SO4 = HBr+NaHSO4;②R-OH+HBr R-Br+H2O
R-Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下
| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目: 来源: 题型:填空题
溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下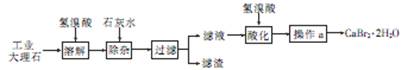
回答下列问题
(1)溶解时发生的主要反应的离子方程式为
(2)除杂步骤控制溶液的pH约为8.0的目的是 ,
(3)滤液用氢溴酸酸化的目的是 ,操作a主要包括 , 和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为 ,发生反应的离子方程式为
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为 ,发生反应的离子方程式为
查看答案和解析>>
科目: 来源: 题型:填空题
从固体混合物A出发可以发生如下框图所示的一系列变化:
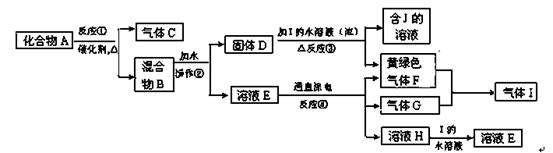
(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)
A B C
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F, 可以将它通过下图中的装置,其中瓶I中盛放的
是 ,瓶II中盛放的是 。
查看答案和解析>>
科目: 来源: 题型:填空题
海水综合利用的工艺流程图如下:
(l)电解NaCl溶液,在电解槽中可直接得到的产品有H2 、 或H2、 。
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是 。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(4)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 ,目的是 ;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由: 。
查看答案和解析>>
科目: 来源: 题型:填空题
趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
查看答案和解析>>
科目: 来源: 题型:填空题
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目: 来源: 题型:填空题
下表是四种盐在不同温度下的溶解度(g/100g水):
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

查看答案和解析>>
科目: 来源: 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: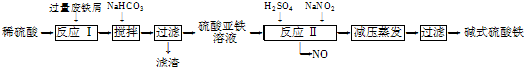
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:填空题
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: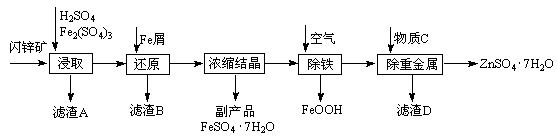
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com