
科目: 来源: 题型:实验题
(6分)A、B、C、D四种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+和阴离子OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。通过实验,得出如下结论:
①A和D的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②铜粉能溶解在B的溶液中;
③往C的溶液中加入过量的D溶液,最终没有沉淀。
根据以上实验事实,回答下列问题:
(1) 试写出A和B的化学式:A ,B___________。
(2) 试写出实验③中反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:实验题
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。请回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用 指示剂,判断到达滴定终点的实验现象是 。
(2)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目: 来源: 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH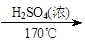 CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等。
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示: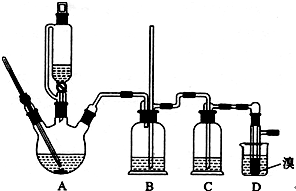
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/oC | 78.5 | 132 | 34.6 |
| 熔点/oC | -130 | 9 | -116 |
查看答案和解析>>
科目: 来源: 题型:实验题
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |

查看答案和解析>>
科目: 来源: 题型:实验题
(9分)海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:
① ;③______________________。
写出实验②中有关反应的离子方程式 _______________________ 。
(2)提取碘的过程中,可供选择的有关试剂是___________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,甘油 |

查看答案和解析>>
科目: 来源: 题型:实验题
(12分)1,2 -二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2 -二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。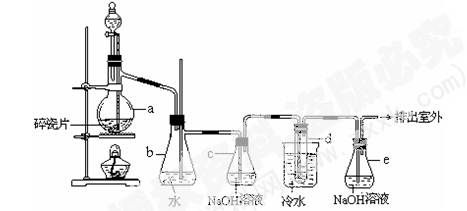
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。_ ;_____________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:____________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: ______________, _____________________。
查看答案和解析>>
科目: 来源: 题型:实验题
下面的框图是测定CuSO4·xH2O中结晶水含量的实验流程。
40. 填写流程中空白的操作名称:(操作II)_____________; (操作V)___________________。
41. 其加热装置正确的是____________(填写编号)。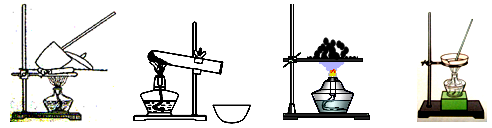
a b c d
42. 重复操作II、III、IV,直到连续两次称量结果相差不超过______g。
43. 操作III必须要在_______(填仪器名称)中进行。
44. 以下胆矾结晶水含量的测定操作正确的是____________(填写编号)。
a. 加热时,晶体溅出坩埚,再加些胆矾
b. 加热时,先用小火,后用大火加热至最后
c. 加热时,不断用玻璃棒搅拌
45. 若实验测得的硫酸铜晶体中结晶水含量偏高,可能的原因有__________(填写编号,下同);若实验测得的硫酸铜晶体中结晶水含量偏低,可能的原因有____________。
a.晶体未完全变白就停止加热
b.加热过程中有少量晶体溅出
c.加热后在空气中自然冷却
查看答案和解析>>
科目: 来源: 题型:计算题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是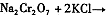
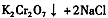 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。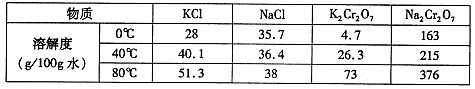
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:计算题
某工厂废液中含有苯酚、乙酸苯酚酌,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L-1 NaOH、0.1 mol?L-1 KSCN、酸性KMnO4溶液、FeCl3溶液、饱和浪水、紫色石蕊试液。
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
查看答案和解析>>
科目: 来源: 题型:计算题
现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
| | 密度 (g·mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 苯甲酸 | 1.2659 | 122.13℃ | 249℃ | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 °C | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |

| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 | |
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 | _________________________, 说明混合液1不含有酚羟基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com