
科目: 来源: 题型:实验题
某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。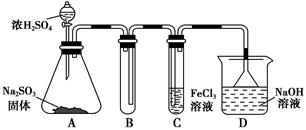
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4 b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目: 来源: 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。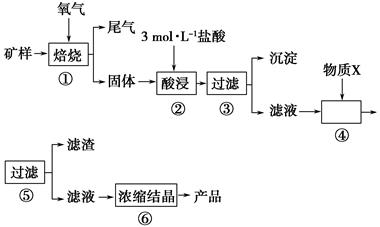
已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:实验题
(14分)某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。
B、C中应盛放的试剂分别是_________和 ,写出C装置中主要的化学方程式:___________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目: 来源: 题型:实验题
某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
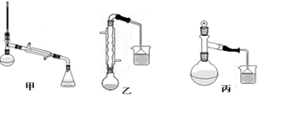
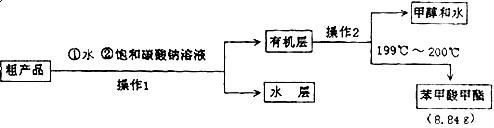
查看答案和解析>>
科目: 来源: 题型:实验题
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。某校化学研究性学习小组为探究草酸的部分性质,进行了如下实验:
(1)为比较相同浓度的草酸和硫酸的导电性,实验室需配制100 mL 0.1mol/L的草酸溶液,配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒、_____ 、____。
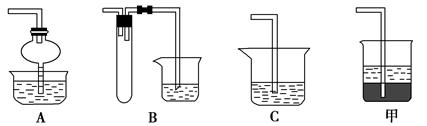
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。请你按整套装置从左至右的顺序填写下表中的空格: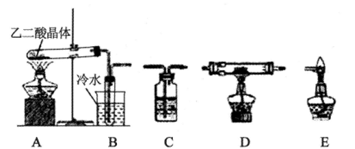

①请写出乙二酸受热分解的化学方程式 _______。
②上述实验中能说明乙二酸热分解生成了还原性气体的实验现象是____。
③检验乙二酸具有较强的还原性,通常选用的试剂是____。
查看答案和解析>>
科目: 来源: 题型:实验题
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
(1)吸硫装置如图所示。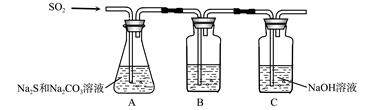
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
查看答案和解析>>
科目: 来源: 题型:实验题
阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
乙酸酐+水杨酸



 粗产品
粗产品



 乙酰水杨酸
乙酰水杨酸
(阿司匹林) 测熔点
测熔点
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |




 乙酰水杨酸
乙酰水杨酸
查看答案和解析>>
科目: 来源: 题型:实验题
实验室合成环己酮的反应、装置示意图及有关数据如下: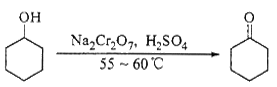
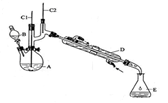
环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 | |
查看答案和解析>>
科目: 来源: 题型:实验题
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH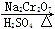 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目: 来源: 题型:实验题
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
可供选择的试剂:饱和Na2CO3溶液,饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用________。
(2)操作①②③④⑤的名称是________(填序号)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com