
科目: 来源: 题型:问答题
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。 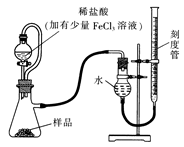
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 .稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。方案I中过氧化镁的质量分数为 (用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量 作指示剂;样品中过氧化镁的质量分数为 (用含V的表达式表示)。
查看答案和解析>>
科目: 来源: 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: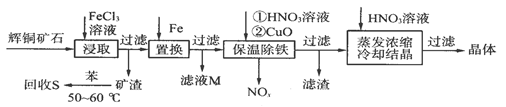
⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。
查看答案和解析>>
科目: 来源: 题型:填空题
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下: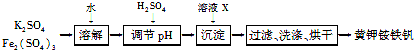
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:填空题
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题: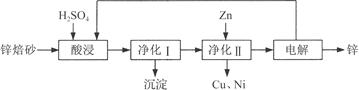
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为___________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是_________________。
⑷本流程中可以循环利用的物质除锌外还有________________。
查看答案和解析>>
科目: 来源: 题型:填空题
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下测定方法。
I.氧化还原法:甲同学拟采用下图所示的装置进行实验: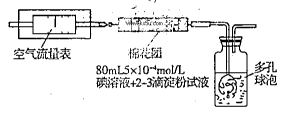
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2 g(精确到0.001),选择_______mL的容量瓶进行配制。该实验所涉及的氧化还原反应原理为 (用化学方程式表示),该实验原理是利用了SO2的 性。
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因 .
Ⅱ.重量法:乙同学拟用右图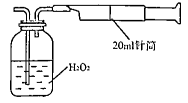 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
(3)取样处空气中SO2含量为 mg/L(精确到0.001)。
(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行 .
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4
(5)请写出该电池负极的电极反应式 。
查看答案和解析>>
科目: 来源: 题型:填空题
某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙: 。
为了验证可能为甲,请完成下列实验方案。限选试剂:
①98%的浓硫酸 ②1%的品红溶液 ③1.0 mol·L-1的KI-淀粉溶液 ④1.0 mol·L-1 的NaOH溶液 ⑤澄清石灰水 ⑥饱和NaCl溶液
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 (填序号); 试管B中加1%品红溶液; 试管C中加 (填序号)。 | 若___ ___, 则甲成立。 |
查看答案和解析>>
科目: 来源: 题型:填空题
(14分)
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | | 36.0 |
| ③ | | 0.2 | 2.0 | 90.0 |
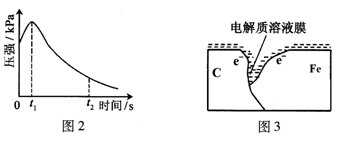
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目: 来源: 题型:填空题
三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂。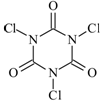
(1)利用三氯异氰尿酸水解产物中的氧化性物质X可消毒灭菌,X的分子式为 。
(2)“有效氯”含量指从KI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。为测定三氯异氰尿酸的“有效氯”含量,现称取某三氯异氰尿酸样品0.5680 g,加水、足量KI、硫酸,配制成100 mL待测液;准确量取25.00 mL待测液于碘量瓶中,用0.1500 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色时,加入淀粉指示剂,继续滴定至终点(发生反应的方程式为:2Na2S2O3+I2=Na2S4O6+2NaI);重复测定2次,所得的相关数据如下表:
| 滴定序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目: 来源: 题型:填空题
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油。
资料一 石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态。
资料二 石油催化裂化中通常使用Al2O3作催化剂。
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。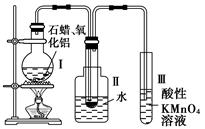
(1)该装置仪器连接的顺序应遵循的原则为__________________,
为保证实验成功,实验前必须进行的操作是_________________,
装置中较长导管的作用是_____________________。
(2)试管Ⅱ中少量液体凝结说明了______。
(3)试管Ⅲ中溶液褪色说明了________________。
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是_______________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式________________。
(6)石油裂化的重要意义是_____________。
查看答案和解析>>
科目: 来源: 题型:填空题
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式____________________________________________________。
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为a mL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞_____________,打开活塞______________,通过分液漏斗加入稀硫酸,与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞_____________,打开活塞_____________,通过分液漏斗加入过量____________(填化学式),与烧瓶内物质充分反应。
④__________________(填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为z g,
(4)数据分析
①AlN的质量分数为___________________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________________(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为________。(该实验条件下的气体摩尔体积为Vm)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com