
科目: 来源: 题型:填空题
(1)下列关于工业生产说法正确的是 。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
| pH | Ca2+ 、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |

查看答案和解析>>
科目: 来源: 题型:填空题
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
已知:水浸后溶液中存在Na2CrO4、NaAlO2[也可表示为NaAl(OH)4]、Na2ZnO2等物质。
(1)水浸后回收Cu、Ni时的操作是 。水浸后的溶液呈 性(“酸”、“碱”、“中”)
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式
Cr(OH)3 + Na2CO3 + O2 Na2CrO4 + CO2 + H2O
Na2CrO4 + CO2 + H2O
(3)滤渣II的主要成分有Zn(OH)2、 。
(4)已知:①除去滤渣II后,溶液中存在如下反应:CrO42—+ 2H+ Cr2O72—+ H2O;②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
Cr2O72—+ H2O;②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目: 来源: 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
已知:Cu2O + 2H+ =" Cu" + Cu2+ + H2O。
(1)滤液A中铁元素的可能存在形式为_______(填离子符号),与之相关的离子方程式为_____________,若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为_____________________________。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是_________(填代号)。
a.若用硫酸铜溶液作电解液,SO2- 4向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
查看答案和解析>>
科目: 来源: 题型:填空题
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: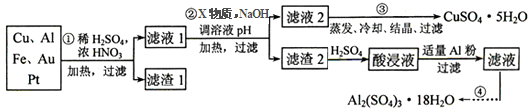
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。查看答案和解析>>
科目: 来源: 题型:填空题
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
| A.矿石加入沸腾炉之前先粉碎 |
| B.使用V2O5作催化剂 |
| C.转化器中使用适宜的温度 |
| D.净化后的炉气中要有过量的空气 |
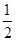 O2(g)
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。查看答案和解析>>
科目: 来源: 题型:填空题
工业接触法制硫酸的简单流程图如下:
(1)写出装置甲的名称________。要使黄铁矿充分和迅速地燃烧,工业上常采取的措施为__________________________________。
(2)接触室中二氧化硫与氧气的反应采用________(填“常压”或“高压”),原因是________________________________。
(3)刚通入接触室中的SO2和O2在热交换器的管道________(填“里”或“外”)流动,在催化剂表面接触反应的SO2和O2在热交换器的管道________(填“里”或“外”)流动,这样两种流体通过管壁进行热交换。
(4)在吸收塔中为什么用98.3%的浓硫酸而不是用水吸收三氧化硫?
______________________________________________________________。
(5)工业接触法制硫酸的过程中,有两个操作过程采用了逆流的原理,它们分别是_____________________________________
查看答案和解析>>
科目: 来源: 题型:填空题
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:__________________、__________________。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是______________;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为______________。
查看答案和解析>>
科目: 来源: 题型:填空题
石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式__________________________________。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)__________。写出有关化学反应的方程式_______________________________
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是________。它(或它们)的主要危害是______________________________
查看答案和解析>>
科目: 来源: 题型:填空题
下表列出了3种燃煤烟气脱硫方法的原理。
| 方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |

查看答案和解析>>
科目: 来源: 题型:填空题
当前,大量施用氮素化肥是冬小麦获得高产的重要措施之一。
(1)施入土壤的氮素化肥主要以________形式被小麦根部吸收,透气性较好的土壤植物容易吸收氮素化肥,透气性较差的黏质土壤,则根的吸肥力差,这是因为_______________________________________________。
(2)施肥后要及时灌溉,若从麦田流失的水从下图A位置注入一条河流,导致下游水体中藻类和细菌数量发生的变化如下列曲线图所示: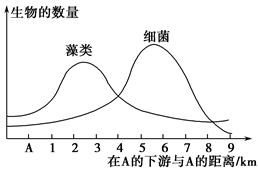
①在A的下游藻类数量增加的原因是____________________________________________________________。
②在3 km以外的河段,细菌数量迅速增加的原因是_____________________________________________________________。
③在下游6 km处的河段发现鱼类大量死亡,原因是______________________________________________________________。
④在距A 2 km处,水中的氧气含量比A处高,原因是______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com