
科目: 来源:不详 题型:实验题
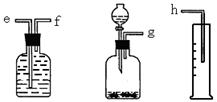

查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染 |
| B.该反应中N2O4是氧化剂,偏二甲肼是还原剂 |
| C.CO2是氧化产物,N2是还原产物 |
| D.每有0.6 mol N2生成,转移电子数目为2.4NA |
查看答案和解析>>
科目: 来源:不详 题型:填空题
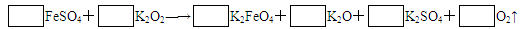
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.ZnI2既是氧化产物,又是还原产物 |
| B.ZnAt2既是氧化产物,又是还原产物 |
| C.AtI与液氨反应,AtI既是氧化剂,又是还原剂 |
| D.AtI与液氨反应,是自身氧化还原反应 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.氮气是还原产物,二氧化碳是氧化产物 |
| B.HCNO中碳元素被氧化 |
| C.1molHCNO参加反应失去3mol电子 |
| D.氧化产物与还原产物物质量比为1:1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O,下列说法正确的是:( )
7N2+8CO2+4H2O,下列说法正确的是:( )| A.C3N3(OH)3与HNCO为同一物质 | B.HNCO是一种很强的氧化剂 |
| C.1 mol NO2在反应中转移的电子为4 mol | D.反应中NO2是还原剂 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.铈的冶炼步骤为:用稀土串级萃法对矿石进行筛选富集;电解熔融CeO2 |
| B.CeO2铈溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2 H2O |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
| D.铈能从硫酸铜溶液中置换出铜:Ce+2Cu2+="2Cu+" Ce4+ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com