
【题目】图甲是乙图中某蛋白质β肽链一端的氨基酸排列顺序,该蛋白质含有两条α肽链,两条β肽链(α肽链和β肽链不同),共由124个氨基酸脱水缩合而成。回答下列问题。
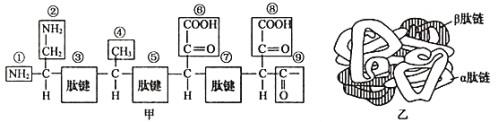
(1)图甲所示的一段肽链有_________种氨基酸脱水缩合而成,氨基酸的种类是由_________(填序号)决定的。
(2)图甲中肽链的第40位氨基酸是甲硫氨酸,它的R基是—CH2—CH2—S—CH3,则甲硫氨酸的分子式是_________。
(3)据图分析,一条β肽链至少含有_________个羧基,若两条β肽完全相同,则一个该蛋白质分子至少含有_________个羧基。
(4)图乙中肽链盘曲过程有三处形成了二硫键(由两个半胱氨酸上的—SH缩合而成,即—SH和HS—缩合成—S—S—)。若组成图乙中蛋白质的氨基酸平均分子量为100,则该蛋白质的分子量为_________。
【答案】3 ②④⑥⑧ C5H11O2NS 3 8 10234
【解析】
分析图乙和题意可知,血红蛋白是由4条肽链组成的;分析图甲可知,①是氨基,②④⑥⑧是R基,③⑤⑦是肽键,据此答题。
(1)据氨基酸的种类由R基决定判断,图甲所示的肽链有3种氨基酸脱水缩合而成。图中氨基酸的R基包括②④⑥⑧。
(2)根据氨基酸的结构通式,一个氨基和一个羧基连接在同一个碳原子上,再连一个氢原子和R基可知,若R基是—CH2—CH2—S—CH3,则甲硫氨酸的分子式是C5H11O2NS。
(3)羧基数=肽链数+R基上的羧基,图中R基上由两个羧基,则一条β肽链至少含有3个羧基。该蛋白质分子共有4条链组成,两条α肽链至少2个羧基,两条β肽链至少至少含有6个羧基,则该蛋白质分子至少含有8个羧基。
(4)蛋白质的分子量=氨基酸的个数×氨基酸的平均分子质量-脱去的水分子数×18-二硫键的个数×2=100×124-(124-4)×18-3×2=10234。


科目:高中生物 来源: 题型:
【题目】图表示该植物在红、蓝紫两种颜色光照条件下(①表示蓝紫光、②表示红光),光合作用强度受CO2浓度影响的变化,据图分析不正确的是

A.b点比c点光合作用强度高的原因是类胡萝卜素不吸收红光
B.图中a点与c点相比较,a点时叶肉细胞中C3的生成速率快
C.图中b点与c点相比较,b点时叶肉细胞中C5的消耗速率快
D.影响图中a点光合作用强度的因素不只有CO2浓度
查看答案和解析>>
科目:高中生物 来源: 题型:
【题目】在氨基酸脱水缩合过程中,氨基酸分子之间形成的化学键叫肽键.下列各项正确表示肽键的是( )
A.﹣NH2﹣CO﹣
B.﹣NO﹣CH﹣
C.﹣NH﹣CO﹣
D.﹣NO﹣CH2﹣
查看答案和解析>>
科目:高中生物 来源: 题型:
【题目】用哺乳动物成熟红细胞制备细胞膜的实验,做不到的是
A.体验制备细胞膜的方法和过程
B.观察细胞吸水后的体积变化
C.离心后可获得纯净的细胞膜
D.检验膜的成分主要是磷脂和蛋白质
查看答案和解析>>
科目:高中生物 来源: 题型:
【题目】神经中枢是神经调节的重要环节。以下是神经中枢及其控制的相关活动的对应关系,不正确的是( )
A.膝跳反射中枢——脊髓B.体温调节中枢——大脑皮层
C.言语区——大脑皮层D.排尿中枢——脊髓
查看答案和解析>>
科目:高中生物 来源: 题型:
【题目】如图表示孟德尔杂交实验过程操作及理论解释,下列选项描述错误的是

A. 图3的交配方式为测交
B. 图1①和②的操作不能同时进行,②操作后要对雌蕊进行套袋处理
C. 图2揭示了基因分离定律的实质,是孟德尔假说—演绎的核心内容
D. 图2揭示减数分裂过程中,随同源染色体1、2的分离,等位基因D、d分离,进入不同配子
查看答案和解析>>
科目:高中生物 来源: 题型:
【题目】已知某条肽链由88个氨基酸缩合而成,其中共有氨基6个,甲硫氨酸5个且在肽链中的位置为3、25、56、78、88,甲硫氨酸的分子式为C5H11O2NS,以下叙述错误的有几项
①合成该多肽的氨基酸共有N原子数目93个
②若去掉多肽中的甲硫氨酸,肽键数目会减少10个
③若去掉该多肽中的甲硫氨酸,氨基和羧基均分别增加5个
④若去掉该多肽中的甲硫氨酸,氧原子数目减少1个
A.一B.二C.三D.四
查看答案和解析>>
科目:高中生物 来源: 题型:
【题目】将某植物的胚芽鞘放在单侧光下照射一段时间,下图为该胚芽鞘尖端以下部位的横切示意图(图中黑点表示生长素),有关叙述正确的是

A. 单侧光照射的是b侧
B. a侧细胞的生长素合成量少于b侧
C. 其向光侧相当于水平放置的植物茎的近地侧
D. a、b两侧的生长差异不能体现生长素作用的两重性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com