
1.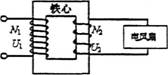 今用一个理想变压器对电风扇进行供电,已知变压器原副线圈的匝数为N1、N2。电压为U1、U2,电流为I1,I2,电风扇内阻为R,下列表达式正确的是
今用一个理想变压器对电风扇进行供电,已知变压器原副线圈的匝数为N1、N2。电压为U1、U2,电流为I1,I2,电风扇内阻为R,下列表达式正确的是
I2N1=I1N2 B.U1N1=U2N2
C.U1I1=U2I2 D.I2=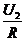
2.我们设想如果地球是个理想的球体,沿地球的赤道修一条闭合的高速公路,一辆性能很好的汽车在这条高速公路上能一直加速下去,并且忽珞空气阻力,那么这辆汽车的最终速度
 A.无法预测 B.与飞机速度相当
A.无法预测 B.与飞机速度相当
C.小于神舟五号宇宙飞船的速度 D.可以达到7.9km/s
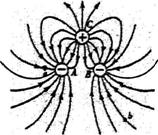
3.三个间距相等,带电量分别为﹣qA、﹣qB、qc的点电荷A、B、C,
产生的电场线分布如图所示,具有对称性.图中a、b两点处的场
强大小分别为Ea、Eb,将某正检验电荷从电场a点移到b点电场
力做功为W,其在a、b两点时的电势能分别为εa和εb,则下列判
断正确的是
A.Ea<Eb B.εa<εb C.W>0 D.qA<qB
4.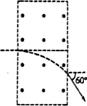 如图所示,在一矩形区域内,不加磁场时,不计重力的带电粒子以某一初速度垂直左边界射入,穿过此区域的时间为t.若加上磁感应强度为B水平向外的匀强磁场,带电粒子仍以原来的初速度入射,粒子飞出时偏离原方向60°,利用以上数据可求出的物理量是
如图所示,在一矩形区域内,不加磁场时,不计重力的带电粒子以某一初速度垂直左边界射入,穿过此区域的时间为t.若加上磁感应强度为B水平向外的匀强磁场,带电粒子仍以原来的初速度入射,粒子飞出时偏离原方向60°,利用以上数据可求出的物理量是
A.带电粒子的比荷 B.带电粒子在磁场中的偏转距离
C.带电粒子的初速度 D.带电粒子在磁场中运动的半径
5. 一小滑块从斜面上A点由静止释放,经过时间4t0到达B处,在5t0时刻滑块运动到水平面的C点停止,滑块与斜面和水平面间的动摩擦因数相同.已知滑块在运动过程中与接触面间的摩擦力大小与时间的关系如图所示,设滑块运动到B点前后速率不变.以下说法中正确的是( )
一小滑块从斜面上A点由静止释放,经过时间4t0到达B处,在5t0时刻滑块运动到水平面的C点停止,滑块与斜面和水平面间的动摩擦因数相同.已知滑块在运动过程中与接触面间的摩擦力大小与时间的关系如图所示,设滑块运动到B点前后速率不变.以下说法中正确的是( )
A.滑块在斜面和水平面上的位移大小之比为4:5
B.滑块在斜面和水平面上的加速度大小之比为5:4
C.斜面的倾角为45°
D.滑块与斜面的动摩擦因数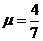
非选择题(本大题共4小题,共68分)
6.(1)(9分)2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈.海姆和康斯坦丁.诺沃肖洛夫,以表彰他们对石墨烯的研究,他们最初是用透明胶带从石墨晶体上“粘”出一片石墨烯的.我们平常所用的铅笔芯中就含有石墨,能导电.某同学设计了探究铅笔芯伏安特性曲线的实验,得到如下数据(I和U分别表示通过铅笔芯的电流和其两端的电压):
实验室提供如下器材:
|
U/V |
0.00 |
0.40 |
0.80 |
1.20 |
1.60 |
2.00 |
|
I/A |
0.00 |
0.10 |
0.18 |
0.34 |
0.38 |
0.48 |
A.电流表A1(量程0.6A,内阻约为1.0Ω)
B.电流表A2(量程3A,内阻约为0.1Ω)
C.电压表V1(量程3V,内阻3kΩ)
D.电压表V2(量程15V,内阻15kΩ)
E.滑动变阻器R1(阻值0-10Ω,额定电流2A)
F.滑动变阻器R2(阻值0~2kΩ,额定电流0.5A)
G.稳压直流电源E(6V),开关和带夹子的导线若干以及长约14cm的绘图2B铅笔芯
①为了完成实验电流表应该选择_______电压表应该选择_______滑动交阻器应该选
择________(填选项前字母);
②下列选项中的实验电路图合理的是________
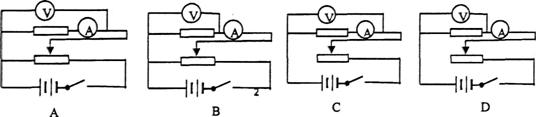
(2)(10分)利用图示装置可以测定喷枪喷射油漆雾滴的速度.将直径D=20cm的纸带环,安放在一个可以匀速转动的转台上,纸带上有一狭缝A,A的正对面有一条标志线.油漆喷枪放在开有狭缝B的纸盒里.转台以角速度ω=2.1rad/s稳定转动后,开始喷漆,喷出来的雾滴运动速度从为不变.仅当狭缝A和B正对平行时,雾滴才能进入纸带环.改变喷射速度v0重复实验,已知v0≥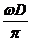 ,在纸带上留下了一系列的痕迹a、b、c、d.将纸带取下放在刻度尺下,如图所示.
,在纸带上留下了一系列的痕迹a、b、c、d.将纸带取下放在刻度尺下,如图所示.
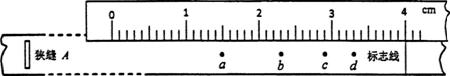
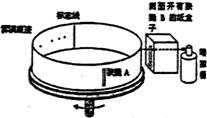 ①速度最小的雾滴所留的痕迹应为______点,该点离标志
①速度最小的雾滴所留的痕迹应为______点,该点离标志
线的弧长为_______cm.
②该喷枪喷出的雾滴的最大速度为_______m/s(结果保留两位有效数字),若考虑空气阻力的影响,该测量值真实值(选填“大于“小于”或“等于”).
7.(15分)足球运动员甲的质量为60.0 kg.当他以6.0 m/s的速度向前运动时,与另一质量为80kg,速度为4.0 m/s的迎面而来的运动员乙相撞.碰后甲恰好静止.假设碰撞时间极短,
求:
(1)碰后乙的速度的大小;
(2)碰撞中总机械能的损失.
8.(16分)如图所示。在空间中有一水平方向的匀强磁场区域,磁场的上下边缘间距为h,磁感应强度为B,有一宽度为b(b<h),长度为L、电阻为R、质量为m的矩形导体线圈紧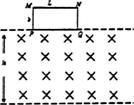 贴磁场区域上边缘从静止下落,当线圈的PQ边到达磁场的下边
贴磁场区域上边缘从静止下落,当线圈的PQ边到达磁场的下边
缘时,恰好开始傲匀速运动。重力加速度为g.求:
(1)PQ运动到磁场下边缘时的速度大小;
(2)线圈的MN边刚好进磁场时的速度大小:
(3)线圈从开始下落到刚好完全进入磁场所经历的时间.
9.(19分)如图所示,在竖直向下足够宽广的xoy平面中,每隔d=0.1m的区域内就有一段宽度为d的区域内存在着竖直向上的匀强电场和垂直纸面向里的匀强磁场,电场强度为E,磁感应强度B=0.1T,有一带电量q=+2.0×10﹣10C质量为m= ×10﹣11kg的带电粒子从O点自由下落,且qE=mg(g=10m/s2)
×10﹣11kg的带电粒子从O点自由下落,且qE=mg(g=10m/s2)
(1)求粒子穿出第一个复合场区域时的速度大小;
(2)求粒子在穿越第二个复合场区域的过程中水平方向的速度变化了多少:
(3)求粒子到达第几个复合场区域时,不能从该区域的下方射出.
10.[选修3﹣3]
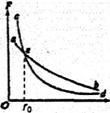 (1)(6分)如图所示,纵坐标表示两个分子间引力.斥力的大小,横坐标表示两个分子间的距离,图中两条曲线分别表示两分子间引力.斥力的大小随分子间距离的变化关系,e为两曲线的交点,则下列说法正确的是
(1)(6分)如图所示,纵坐标表示两个分子间引力.斥力的大小,横坐标表示两个分子间的距离,图中两条曲线分别表示两分子间引力.斥力的大小随分子间距离的变化关系,e为两曲线的交点,则下列说法正确的是
A.ab为斥力曲线,cd为引力曲线
B.P点横坐标的数量级为r0=﹣10﹣9m
C.当r=r0时,改交分子间距r,则分子势能一定增大
D.当r=r0时,改变分子间距r,则分子势能一定减小
(2)(6分)如图1所示,一导热性良好内壁光滑的气缸放置
 在水平平台上。活塞质量为20kg,横截面积为20cm2,气缸全长25cm,气缸质量30kg,大气压强为1×105pa,当温度为27℃时,活塞封闭的气柱长为10cm,现将汽缸水平放置放置如图2所示,g=10m/s2,求稳定后的气柱长度.
在水平平台上。活塞质量为20kg,横截面积为20cm2,气缸全长25cm,气缸质量30kg,大气压强为1×105pa,当温度为27℃时,活塞封闭的气柱长为10cm,现将汽缸水平放置放置如图2所示,g=10m/s2,求稳定后的气柱长度.
化学(100分)
可能用到的相对原子质量: H﹣l C﹣12 N﹣14 O﹣16 S﹣32 K﹣39 Fe﹣56 Zn﹣65
1.下列说法正确的是
A.钠和钾的合金具有导电性,可用于快中子反应堆热交换剂
B.采用催化措施,将汽车尾气中的CO和NO转化为无害气体
C.信息产业中的光缆的主要成分是单质硅
D.水玻璃易溶于水,可用于生产黏合剂和防火剂
2.下列有关实验叙述正确的是
A.向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性
B.除去苯中混有的苯酚可加入浓溴水后过滤
C.向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应
D.向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应
3.下列离子方程式正确的是
A.铜溶于浓硝酸:Cu+2H++NO3﹣===Cu2++NO2↑+H2O
B.用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O===3I2+6OH﹣
C.向NaAlO2溶液中通入过量的CO2:2AlO﹣+CO2+3H2O===2Al(OH)3↓+CO32﹣
D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:
CH3CHO+2Cu(OH)2+OH﹣CH3COO﹣+Cu2O↓+3H2O
4.西维因是一种高效低毒杀虫剂,在碱性条件下可水解:
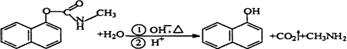
则下列说法正确的是
A.西维因是一种芳香烃 B.西维因分子中所有碳原子一定共面
C.可用FeCl3溶液检验西维因是否发生水解 D.在Ni催化加热条件下西维因不能与H2加成
5.水溶液中只可能有K+、Mg+、AlO2﹣、Al3+、SiO32﹣、CO32﹣、SO42﹣中的若干种离子。某同学对溶液进行了如下实验:
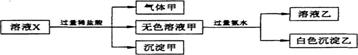
下列判断错误的是
A.有气体甲生成,表明溶液X中一定含有CO32﹣ B.沉淀甲不可能是硅酸镁
C.Al3+一定存在于溶液X中 D.不可能确定SO42﹣是否存在于溶液X中
6.下列关于各图像的解释或结论正确的是
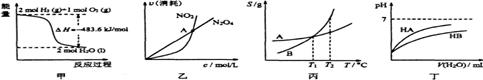
A.由甲可知:热化学方程式是H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)
B.由乙可知:对于恒温恒容条件下的反应2NO2(g) N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃对,溶质的质量分数B>A
D.由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
7.a mol FeS与b mol FeO投入到V L、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④cV﹣(9a+b)/3mol
A.①④ B.②④ C.①③ D.②③
8.(18分)A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强
的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外
层电子数与内层电子数之比为3:5,A与E同族。
(1)D的原子结构示意图为____________
(2)B单质在氧气中燃烧生成化合物甲,甲中所含化学键为___________
甲的电子式为__________________。
(3)含C元素的化合物常用作净水剂,用文字和化学用语解释净水原因:
___________________________________________________________________________________
(4)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反
应前后的转化关系,写出该转化过程的化学方程式:_____________________________________。
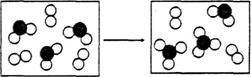
(5)工业上将干燥的F单质通入E熔融的单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为_____________________________________________________________。
(6)a为碳元素,其与E元素形成的化合物GE2是一种有恶臭的液体,把它滴入硫酸酸化的高锰酸钾水溶液,将析出硫磺,同时放出CO2,写出配平的化学式方程式
_____________________________________________________________________________________
(7)立方ZnS晶体结构与D的单晶体相似,其晶胞边长为acm,密度为_________g.cm3
(只列式不计算,用NA表示阿伏加德罗常数)
9.(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
I打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
II打开活塞a,滴加一定量的浓盐酸,给A加热。
III当B中的溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子。
V打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ更新试管D,重复过程Ⅳ,检验B溶液中的离子。
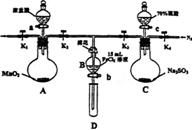
(1)过程I的目的是____________________________________________________________
(2)棉花中浸润的溶液为_______________________
(3)A中发生反应的化学方程式为_________________________________________________
(4)用70%的硫酸制取SO2。反应速率比用98%的硫酸快,原因是__________________________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是_____________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
|
|
过程IV
B溶液中含有的离子 |
过程ⅥB溶液中含有的离子 |
|
甲 |
有Fe3+无Fe2+ |
有SO42﹣ |
|
乙 |
既有Fe3+又有Fe2+ |
有SO42﹣ |
|
丙 |
有Fe3+无Fe2+ |
有Fe2+ |
10.(14分)三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3].3H2O)有很重要的用途。可用如下流程来制备.根据题意完成下列各题:
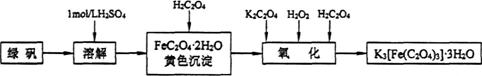
(1)要从溶液中得到绿矾,必须进行的实验操作是____________。(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3].3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤2:取所配溶液25.00ml于锥形瓶中。加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时MnO4﹣原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍显酸性。
步骤3:在酸性条件下。用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00mL,滴定中MnO4﹣,被还原成Mn2+。
(2)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有_________;主要操作步骤依次是:称量、溶解、转移、_________、定容、摇匀。
(3)步骤2中,加入锌粉的目的是_______________________________________________________。
(4)步骤3中,发生反应的离子方程式为:_______________________________________________。
(5)步骤2中,若加入KMnO4溶液的量不够,则测得的铁含量___________。(选填“偏
低”、“偏高”、“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体。研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3。写出该分解反应的化学方程式_______________________________________________________________________________
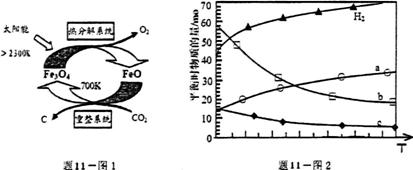
11.(14分)二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战路方向,CCUS或许发展成一项重要的新兴产业。
(1)国外学者提出的由CO2制取C的太阳能工艺如题11图1所示:
①“热分解系统”发生的反应为2Fe3O46FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为______________。
②“重整系统”发生反应的化学方程式为___________________________________________________。
 (2)CO2催化加氢合成低碳烯烃是目前研究的热门课题,起始以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)
(2)CO2催化加氢合成低碳烯烃是目前研究的热门课题,起始以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,不同温度下平衡时的四种气态物质的物质的量细题11图2所示。
C2H4(g)+4H2O(g) △H,不同温度下平衡时的四种气态物质的物质的量细题11图2所示。
①曲线b表示的物质为__________(写化学式)。
②该反应的△H_______0填:“>”或“<”
③为提高CO2的平衡转化率,除改变温度外,还可采取的
措施是_________(列举1项).
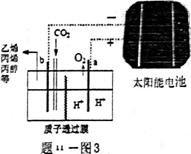
(3)据报道以CO2为原料采用特殊的电极电解强酸性的二
氧化碳水溶液可得到多种燃料,其原理如题11图3所示。
①该工艺中能量转化方式主要有_____________________
(写出其中两种形式即可)。
②电解时其中b极上生成乙烯的电极反应式为_______________
生物(共90分)
1、下列关于细胞结构和生物体内化合物的叙述正确的是
A.在酶促反应中,反应终产物过量致使酶的活性下降,属于负反馈调节
B.肌细胞能产生二氧化碳的场所为线粒体和细胞质基质
C.蓝藻和绿藻都能进行光合作用,故二者含有的光合色素相同
D.抗体、激素、tRNA发挥一次作用后都将失去生物活性
2、下列关于实验的说法,正确的是
A.观察线粒体时,可用嫩而薄的藓类叶代替口腔上皮细胞
B.探究低温诱导植物细胞染色体数目变化,能观察到新细胞壁的生成过程
C.用豌豆取材来观察减数分裂时,优选花粉
D.恩格尔曼的水绵实验中好氧细菌的作用是检测氧气的释放部位
3、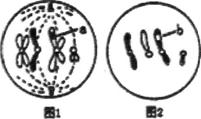 下图为某高等生物细胞某种分裂的两个时期的结构模式图,a、b表示染色体片段。下列关于两图叙述错误的是
下图为某高等生物细胞某种分裂的两个时期的结构模式图,a、b表示染色体片段。下列关于两图叙述错误的是
A.上图说明该细胞分裂过程中可能发生了基因重组
B.若两细胞来源于同一个卵原细胞,且图2是卵细胞,则图1可能是次级卵母细胞
C.同源染色体上等位基因的分离不可能发生在两图所处的分裂时期,相同基因的分离则可发生在图1细胞的分裂后期
D.图1细胞处在减数第二次分裂中期,此时期没有遗传物质的复制,两细胞中染色体数目之比为1:1
4、急性早幼粒细胞白血瘸是最凶险的一种白血病,发病机理如下图所示,2010年度国家最
高科学技术奖获得者王振义院士发明的“诱导分化疗法”联合应用维甲酸和三氧化二砷治疗
该病。其中维甲酸通过修饰PML-RARa,使癌细胞重薪分化“改邪归正”:而三氧化二砷则可
以引起这种癌蛋白的降解,使癌细胞发生部分分化并最终进入凋亡。下列有关分析不正确的
是
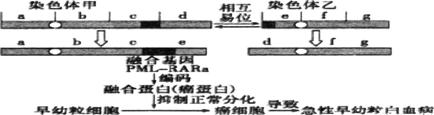
A.这种自血病是早幼粒细胞发生了染色体变异引起的
B.这种白血病与早幼粒细胞产生新的基因有关
C.“诱导分化疗法”将有效减少病人骨髓中积累的癌细胞
D.维甲酸和三氧化二砷作为化学药物诱导癌细胞的DNA结构发生了改变
5、下图示“番茄-马铃薯”杂种植株的培育过程,其中①-⑤表示过程,字母表示细胞、组织或植株。下列说法正确的是
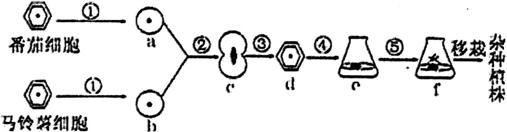
A.①表示低渗溶液中用酶解法处理植物细胞获得原生质体
B.利用聚乙二醇、灭活的病毒和电激等方法可实现②
C.可根据质壁分离现象鉴别杂种细胞的细胞壁是否再生
D.上述过程中包含着有丝分裂、细胞分化和减数分裂等过程
6、英国科学家维尔穆特首次用羊的体细胞(乳腺细胞)成功地培育出一只小母羊,取名“多利”,这一方法被称之为“克隆”,以下四项中与此方法在本质上最相近的是
A。将鼠骨髓瘤细胞与经过免疫的B淋巴细胞融合成杂交瘤细胞,制各单克隆抗体
B.将人抗病毒基因嫁接到烟草DNA分子上,培育出具有抗病毒能力的烟草新品种
C.将兔的早期胚胎分割后,分别植入两只母兔的子宫内,并最终发育成两只一样的兔子
D.将人的精子与卵细胞在体外受精,待受精卵在试管内发育到囊胚期时,再植入女性子宫内发育成“试管婴儿”
7.(20分)下图为某同学“饥寒交迫’’对体内的一些生理变化过程示意图(A-D为器官或细胞,①-④为激素)。结合所学知识,回答下列问题:
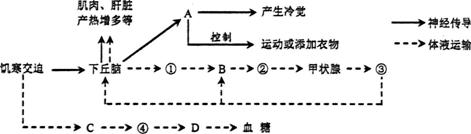
(1)人体的体温调节中枢位于________,兴奋在传入神经上以________形式传导。
(2)图示中A通过控制运动来调节体温过程属于________(条件/非条件)反射。
(3)当激素③以B为靶细胞对,体现了激素的________调节。③对B的作用效应有________________________(答2点)。
(4)激素④的最主要靶器官(细胞)是________。
(5)经机体调节,寒冷环境比炎热环境中散热更________(多/少),相同饮水量的情况下,抗利尿激素分泌更________(多/少).
(6)研究表明,长期饥寒交迫的人,体内T细胞的数量及对抗原识别的灵敏度均较低,________免疫能力降低,极易患病。据此提醒高三同学,勿盲目节食,天冷需风度,更需温度。
(7)综上,________调节网络是机体维持稳态的主要调节机制。
8.(14分)0℃以上的低温能对喜温植物玉米造成伤害,科研人员进行了实验研究。
实验一:从甲,乙、丙三个品种中挑选长势相同的玉米幼苗若干,平均分为三组,分别放在5℃、10℃和25℃的环境中培养4天(其他各种条件都相同且适宜),结果如图1。
实验二:将甲种玉米幼苗分成三组,一组对照,另两组在5℃低温下处理4天后放在25℃,光照强度分别为800勒克斯(1x)、60勒克斯(1x)的条件下恢复4天后,测其光强与光合速率的关系,结果如图2.
(1)实验一的目的是________________________。
(2)甲、乙、丙三个品种中最耐低温的是________,判断的依据是,该品种在低温条件下________。
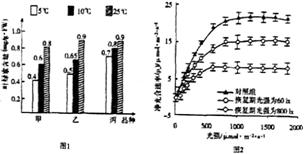
(3)实验二的目的是探究低温伤害后恢复期光照强度的不同对恢复后光合速率的影响。
该实验对照组的处理条件应为:一直生长在温度为________,光强为800 1x条件下。
(4)由实验二可知,________________。
(5)结合实验一、二分析,早春遭遇“倒春寒”后会造成玉米减产的原因分别是________
(6)实验期间,低温处理的玉米的干重并未受到影响,其原因可能是________________。
9.(20分)某种鸟类(2N=76)为ZW型性别决定,其羽毛中的黑色素由等位基因A/a中
的A基因控制合成,且A基因越多,色素越多。回答下列问题:
(1)若等位基因A/a位于2染色体上。
①雌鸟羽毛的颜色有________种,其产生卵细胞的过程中可以形成________个四分体。
②用两只羽毛颜色相同的个体杂交,子代出现了性状分离现象,则亲代基因型为________,子代中黑色羽毛:灰色羽毛:白色羽毛=________。
(2)若等位基因A/a位于常染色体上,另有一对不在性染色体上的控制色素分布的等位基因B/b。研究者进行了如图杂交实验:
 ①根据杂交实验可以判断,A/a和B/b所在染色体属于________(同源/非同源)染色体,能够使色素分散形成斑点的基因型是________。
①根据杂交实验可以判断,A/a和B/b所在染色体属于________(同源/非同源)染色体,能够使色素分散形成斑点的基因型是________。
②F2中基因型种类最多的性状是________,让F2中的纯灰色雄鸟与灰色斑点雌鸟杂交,子代纯黑的概率占________,子代不周于亲代羽毛性状的个体占________。
④斑点羽毛的鸟在自然环境中比纯色羽毛的鸟更容易被天敌发现,将F2全部个体放归自然界多年后,种群中A基因的频率将________填“变大”、“不变”或“变小”)。