
1.当前,我国急待解决的“白色污染”通常是指( )
A.冶炼厂的白色烟尘 B.石灰窑的白色粉末
C.聚乙烯等塑料垃圾 D.白色建筑材料
2.“绿色化学工艺”是消除污染的重要手段,其理想工艺是反应物里的原子全部转化到欲制取的物质中.下列化学反应类型一定属于“绿色工艺”的是( )
A.置换反应 B.分解反应 C.化合反应 D.氧化反应
3. 如图是2014年南京青奥会吉祥物砳砳(lè
如图是2014年南京青奥会吉祥物砳砳(lè lè
lè ),其外材料为纯羊毛,内充物是PET材料,该材料的化学式是(COC6H4COOCH2CH2O)n。PET材料是( )
),其外材料为纯羊毛,内充物是PET材料,该材料的化学式是(COC6H4COOCH2CH2O)n。PET材料是( )
A.金属材料
B.有机高分子材料
C.非金属材料
D.无机高分子材料
4.“神州十号”在酒泉卫星发射中心,于2013年6月11日17时38分,由长征二号F改进行运载火箭发射,6月26日回归地球。飞船在重返大气层时,由于同空气的剧烈摩擦,船体的表面温度将上升到2000℃-3000℃,因此飞船表面必须有良好的防高温措 施。下列有关飞船的防高温措施中不可取的是(
施。下列有关飞船的防高温措施中不可取的是(  )
)
A.使用陶瓷类的贴面覆盖船体,以防止高温侵入舱内
B.使用在一定条件下能熔化或气化的表面覆盖材料
C.使用在一定条件下能与大气层中的氧气发生剧烈燃烧的表面覆盖材料
D.使用在一定条件下能发生分解反应的表面覆盖材料
5.所谓合金,就是不同金属(或金属与非金属)在熔化状态下形成的一种具有金属特性的熔合物。下列四种金属不能形成合金的是( )
|
金属 |
铜 |
铝 |
铁 |
钠 |
|
熔点/℃ |
1083 |
660 |
1535 |
97.5 |
|
沸点/℃ |
2595 |
2200 |
3000 |
883 |
A.铁和钠 B.铝和钠 C.铁和铜 D.铝和铜
6.氢气和一氧化碳的性质相似,下列鉴别一氧化碳和氢气的方法正确的是( )
A.点燃两种气体,观察火焰的颜色
B.将两种气体分别与空气混合,观察是否发生爆炸
C.点燃两种气体,分别在火焰的上方罩一个干燥的烧杯,观察内壁有无水滴
D.用湿润的蓝色石蕊试纸检验,观察颜色的变化
7.下列离子能在pH=1的无色溶液中大量共存的是( )
A.Cu2+、SO42-、Cl-、Na+ B.OH-、K+、NO3-、Ba2+
C.Mg2+、SO42-、Al3+、NO3- D.Na+、CO32-、Ca2+、Cl-
8.下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别出来的是( )
A.NaOH、CuSO4、BaCl2、KNO3 B.HCl、KOH、NaCl、K2CO3
C.Ca(OH)2、Na2CO3、BaCl2、KNO3 D.NaNO3、MgCl2、KCl、Ba(OH)2
9.某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是( )

A.cba B.cda
C.cbd D.bca
10.在氢气还原氧化铜的实验中,进行如下操作:①加热 ②停止加热 ③通入氢气 ④停止通入氢气。下列操作顺序正确的是( )
A.③①④② B.①③②④
C.③①②④ D.①③④②
11.自来水常用二氧化氯(ClO2)来杀菌消毒,它能转化为可溶性氯化物。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售。为辨别真伪,你想选用的化学试剂是( )
A.氯化钡溶液 B.石蕊试液
C.硝酸银溶液 D.氢氧化钠溶液
12.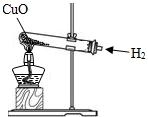 进行如图实验,加热一段时间后,可观察到有红色物质出现,说明氢气具有( )
进行如图实验,加热一段时间后,可观察到有红色物质出现,说明氢气具有( )
A.还原性
B.可燃性
C.氧化性
D.助燃性
13.有编号为①② ③④的四瓶无色液体,仅知道是稀盐酸、食盐水、NaOH稀溶液和酚酞试液。现要求甲、乙、丙、丁四位学生进行鉴别,且每人只鉴别两瓶溶液。实验成绩评定标准为:鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格.四位学生的鉴别结果与老师的评价如下:
③④的四瓶无色液体,仅知道是稀盐酸、食盐水、NaOH稀溶液和酚酞试液。现要求甲、乙、丙、丁四位学生进行鉴别,且每人只鉴别两瓶溶液。实验成绩评定标准为:鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格.四位学生的鉴别结果与老师的评价如下:
|
学生序号 |
鉴别结果 |
老师评价 |
|
甲 |
③号为食盐水④号为稀盐酸 |
四位学生都及格, 但是没有一位  得 得满分 |
|
乙 |
①号为稀盐酸④号为NaOH稀溶液 |
|
|
丙 |
②号为稀盐酸④号为酚酞试液 |
|
|
丁 |
②号为NaOH稀溶液 ③号为稀盐酸 |
下列鉴别结果中正确的结论是( )
A.①号为NaOH稀溶液 B.②号为食盐水
C.③号为稀盐酸 D.④号为酚酞试液
14.检验某溶液是否呈酸性,有四位同学分别设计下列4种方法,其中不正确的是( )
A.在原溶液中滴加碳酸钠溶液,看是否有气泡产生
B.在原溶液中滴加酚酞试液,看是否变色
C.在原溶液中滴加紫色石蕊试液,看是否变色
D.在原溶液中加入锌粒,看是否产生气泡
15.实验室里用如图所示装置还原氧化铁,关于该实验下列说法错误的是( )
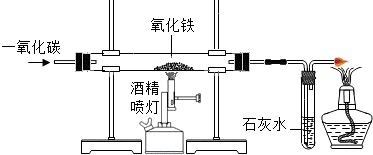
A.玻璃管中发生的反应属于复分解反应
B.该实验说明了一氧化碳既可以燃烧又有还原性
C.实验观察到的现象为红棕色固体变黑,澄清石灰水变浑浊
D.实验时,先通入纯净的一氧化碳,再点燃酒精喷灯给玻璃管加热
16.下列各组物质间能发生反应,且现象描述正确的是( )
A.CO2与NaOH溶液,产生白色浑浊
B.Al(OH)3与稀H2SO4,没有明显现象
C.MgO与稀HCl,白色固体溶解
D.CuSO4溶液与NaCl溶液,产生蓝色沉淀
17.A、B、C、D四种化合物均由Na、S、H、O四种元素中的两种或三种组成,A为中性,既可与CaO反应生成碱,又可与CO2反应生成酸,B可与HCl反应生成盐和水,C可与NaOH反应生成盐和水,D可与Ba(NO3)2反应生成另外两种盐,判断下列说法错误的是( )
A.A一定是水 B.B可能是NaOH
C.C一定是H2SO4 D.D可能是Na2SO4
18.下列除去物质中的少量杂质(括号内为杂质)的方法,正确的是( )
A.CO(CO2)--通过足量的灼热氧化铜
B.MnO2粉末(KCl)--溶解、过滤、洗涤、干燥
C.FeSO4溶液(CuSO4)--加入足量锌粉、过滤
 D.Na2SO4溶液(NaCl)--加入适量硝酸银溶液、过滤
D.Na2SO4溶液(NaCl)--加入适量硝酸银溶液、过滤
19.如图所示 ,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是( )
,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是( )
A.X(H2);Y(N2
 );Z(水)
);Z(水)
B.X(HCl);Y(CO2);Z(石灰水)
C.X(CO2);Y(O2);Z(烧碱溶液)
D.X(HCl);Y(O2);Z(硝酸银溶液)
20.小红同学为研究金属腐蚀的条件,用细尼龙线将三根大小相同的铁钉分别固定在如图所示的三个液面高度相同的相同装置中,放置一星期后观察现象。下列描述错误的是( )

A. 装置Ⅰ的铁钉一侧的液面一定会上升
装置Ⅰ的铁钉一侧的液面一定会上升
B.装置Ⅰ、Ⅱ中的铁钉都被腐蚀
C.比较铁钉一侧的液面,装置Ⅱ比装置I的高
D.装置Ⅲ中的铁钉几乎没被腐蚀
21. 小李学习二氧化碳知识后,进行了二氧化碳气体在水中溶解性的探究,其实验步骤及装置如下。
小李学习二氧化碳知识后,进行了二氧化碳气体在水中溶解性的探究,其实验步骤及装置如下。
①用大号针筒抽取200毫升二氧化碳气体。
②试剂瓶中加入200毫升水(恰好加满),塞紧双孔橡皮塞。
③连接大号针筒和试剂瓶,缓慢推动活塞,将二氧化碳注入水中。
(1)试剂瓶中加入的水应时 (填蒸馏水、自来水)
(2)推动活塞时尽量缓慢,其目的是 。
(3)当向水中注入CO2气体体积达到120毫升时,红色油柱开始向上移动。实验表明在该条件下,1体积水中能溶解 体积的二氧化碳。
22. 商代司母戊方鼎(如图)标志着我国在
商代司母戊方鼎(如图)标志着我国在 3000多年前青器铸造已达到一个较高的水平。西汉时期,我国首开“湿法炼铜”之先河,西汉刘安所著的《淮南万毕术》中有“曾青得铁化为铜”的记载.试回答下列问题:
3000多年前青器铸造已达到一个较高的水平。西汉时期,我国首开“湿法炼铜”之先河,西汉刘安所著的《淮南万毕术》中有“曾青得铁化为铜”的记载.试回答下列问题:
(1)青铜属于 (填“单质”、“化合物”、“高分子材料”、“合金”“复合材料”中之一)
(2)“湿法炼铜”的原理可用一个化学方程式表示为: 。
(3)上述化学反应属于 反应。
23.为保证潜水艇长时间潜行,在潜水艇内要配备氧气再生装置.有下列几种制取氧气的方法:①加热高锰酸钾;②加热氧化汞生成汞和氧气;③常温下,过氧化钠(Na2O2)与二氧化碳反应生成碳酸钠和氧气。你认为最适合在潜水艇内制取氧气方法是 (填序号);写发生反应的化学式 ;与其他方法相比,该方法的优点是 (写两点)
24.有一包固体粉末.可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成.有关实验结果如下:
(1)将此固体粉末投入到足量水中,得到白色沉淀,上层清液呈无色;
(2)过滤得白色沉淀,加入过量的稀硝酸,沉淀完全不溶解的。
由此判断:原固体粉末中,一定含有 ; 一定没有 ;可能含有 。
25.一氧化碳气体在生产生活中有着广泛的应用。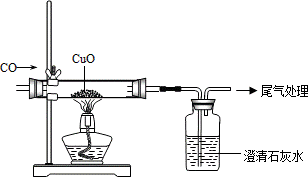
(1)下列对一氧化碳的有关描述,错误的是 (填序号)。
A.组成:由碳原子和氧原子组成
B.性质:能燃烧
C.用途:可以作为燃料
D.危害:易与血液中的血红蛋白结合引起中毒
(2)如图是一氧化碳还原氧化铜的装置。指出实验中能证明发生了化学变化的证据(写一条) 。
26.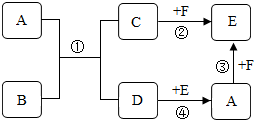 A-F都是初中化学中常见的物质。已知:A是一种盐,但是其水溶液能使酚酞变红;C是建筑业常用的材料,E是一种能使澄清石灰水变浑浊的气体.它们的转化关系如图所示.请回答:
A-F都是初中化学中常见的物质。已知:A是一种盐,但是其水溶液能使酚酞变红;C是建筑业常用的材料,E是一种能使澄清石灰水变浑浊的气体.它们的转化关系如图所示.请回答:
(1)物质A是 ,物质D的俗名是 ;
(2)写出物质反应③的化学方程式 ;
(3)反应①的反应基本类型是 。
27. 实验是研究物质性质重要途径。甲烷除具有可燃性外,还具有什么性质?小军按图装置进行实验,一段时间后,观察到
实验是研究物质性质重要途径。甲烷除具有可燃性外,还具有什么性质?小军按图装置进行实验,一段时间后,观察到 黑色的氧化铜变为红色,白色
黑色的氧化铜变为红色,白色 无水硫酸铜变为蓝色,澄清的石灰水变浑浊。
无水硫酸铜变为蓝色,澄清的石灰水变浑浊。
(1)写出C装置中反应的化学方程式:
。
(2)写出A装置硬质玻璃管中发生反应的化学方程式: ,由此说明甲烷还具有 性。
28.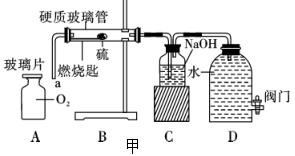 硫燃烧产生的二氧化硫气体会造成空气污染。为避免二氧化硫污染空气,某教师对教材中“硫在空气和氧气中燃烧”的实验进行了改进与创新,设计了如图甲所示的实验装置。
硫燃烧产生的二氧化硫气体会造成空气污染。为避免二氧化硫污染空气,某教师对教材中“硫在空气和氧气中燃烧”的实验进行了改进与创新,设计了如图甲所示的实验装置。
[实验原理]
①B装置中燃烧匙固定在带有a导管的单孔塞上,硬质玻璃管透光性好 ,不影响实验现象的观察;
,不影响实验现象的观察;
②C装置的广口瓶中盛放氢氧化钠溶液可吸收二氧化硫气体,避免污染;
③打开D装置中的阀门,气体就会从左向右依次进入各装置。
[实验过程]
步骤一:将硫粉放在燃烧匙上,在空气中点燃后,迅速伸入硬质玻璃管内(如图B),打开阀门,观察硫在空气中燃烧的现象;
步骤二:将导管a伸入盛有氧气的集气瓶中(如图A),观察硫在氧气中燃烧的现象。
[交流讨论]
(1)硫在空气中燃烧并发出 火焰,生成的SO2气体被氢氧化钠溶液吸收的反应原理是 (用化学方程式表示);
(2)气流能从左向右作定向流动的原因是 。
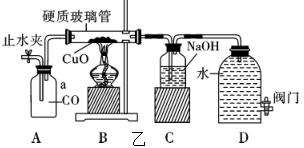 [拓展应用]
[拓展应用]
小丽同学认为,运用该装置设计原理,还能进行其它有毒气体的实验,同样能达到避免污染的目的。于是设计了图乙实验装置,用以完成“CO还原氧化铜”实验。
(3)图乙D装置在实验中除了形成气体定向流动外,还有的用途是 ;
(4)实验时,小丽同学先打开止水夹和阀门,过一会儿再点燃酒精灯,她这样操作的目的 。
29.某炼铁厂用含杂质20%的赤铁矿(主要成分是Fe2O3)冶炼生铁。求800吨这种矿石可炼出含杂质20%的生铁多少吨?
30.现一块铜合金,可能是黄铜(铜、锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成。
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2 价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn-119,Ni-59
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn-119,Ni-59
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
|
次数 |
1 |
2 |
3 |
4 |
|
加入酸质量/g |
5.0 |
5.0 |
5.0 |
5.0 |
|
剩余固态质量/g |
4.5 |
4 |
3.5 |
3.2 |
试求:(1)合金中铜的质量分数 (2)合金中另一金属的种类