
1.下列有关晶体的叙述中,错误的是 ( )。
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个
C.金属晶体中,以“……ABCABCABC……”形式的堆积称为面心立方堆
积
D.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
解析 NaCl晶体中,Na+周围 最近的Na+在小立方体的面对角线上,故有12个Na+最近且等距离。
最近的Na+在小立方体的面对角线上,故有12个Na+最近且等距离。
答案 B
2.下列关于晶体的说法,一定正确的是 ( )。


CaTiO3的晶体结构模型(图中Ca2+、O2-、
Ti4+分别位于立方体的体心、面心和顶角)
A.分子晶体中都存在共价键
B.如上图,CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
解析 稀有气体为单原子分子,晶体中不存在共价键。据图可知CaTiO3晶体中,Ti4+位于晶胞的顶角,O2-位于晶胞的面心,故Ti4+的O2-配位数为12。SiO2晶体中每个硅原子与四个氧原子相连。汞常温下为液态,其熔点比一般分子晶体还低。
答案 B
3.(2013.广安质检)下面的排序不正确的是 ( )。
A.晶体 熔点的高低:
熔点的高低: >
>
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
解析 A项形成分子间氢键的熔、沸点要大于形成分子内氢键的物质,正确;B项均为原子晶体,原子半径越小,键长越短共价键越牢固,硬度越大,键长有:C-C<C-Si<Si-Si,故硬度相反,正确;C项均为金属晶体,熔点大小取决于原子半径大小以及阳离子所带电荷数,其规律是离子半径越小,所带电荷数越多,熔点越高,则熔点Al>Mg>Na,C不正确;晶格能越大,则离子键越强,离子所带电荷相同时离子键的强弱与离子半径有关,半径越小,则离子键越强,D项正确。
答案 C
4.现有四种晶体的晶胞,其离子排列方式如下图所示,其中化学式不属MN型的是 ( )。

解析 由均摊法可得A、C、D晶胞的M与N的个数比为1∶1,而B晶胞中M与N的个数比为1∶3,故B项不属于MN型。
答案 B
B
5.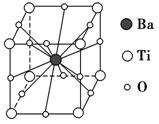 钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是 ( )。
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是 ( )。
A.BaTi8O12 B.BaTi4O6
C.BaTi2O4 D.BaTiO3
解析 由晶胞结构示意图可知,Ba在立方体的中心,完全属于该晶胞;Ti处于立方体的8个顶点,每个Ti有属于该晶胞;O处于立方体的12条棱的中点,每个O有属于该晶胞。即晶体中N(Ba)∶N(Ti)∶N(O)=1∶∶=1∶1∶3。
答案 D
6.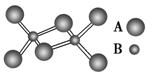 (2013.南充调研)某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8
(2013.南充调研)某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8 电子稳定结构。下列关于该化合物的说法不正确的是 ( )。
电子稳定结构。下列关于该化合物的说法不正确的是 ( )。
A.化学式是Al2Cl6
B.不存在离子键和非极性共价键
C.在固态时所形成的晶体是分子晶体
 D.是离子化合物,在熔融状态下能导电
D.是离子化合物,在熔融状态下能导电
解析 由题意知该化合物为分子晶体,A为Cl,B为Al,分子的结构式为 ,存在极性键和配位键。
,存在极性键和配位键。
答案 D
7. 已知NaCl的摩尔质量为58.5 g.mol-1,其晶体密度为d g.cm-3,若图中钠离子与
已知NaCl的摩尔质量为58.5 g.mol-1,其晶体密度为d g.cm-3,若图中钠离子与 最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示为 ( )。
最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示为 ( )。
A .117a3d B.58.5/(2a3d)
.117a3d B.58.5/(2a3d)
C.234/(a3d) D.58.5/(4a3d)
解析 a3.dNA=×58.5,NA=。
答案 B
8.(14分)铜及其合金是人类最早使用的金属材料。
(1)铜原子的核外电子排布式是________________。
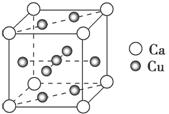
(2)铜的熔点比钙的高,其原因是________________;如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数之比为________。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键 B.金属键
C.极性共价键 D.非极性共价键
E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
解析 (1)铜元素原子的核外电子排布满足“全空、半满、全满稳定”的原理。(2)金属的物理性质主要取决于金属键的强弱,一般金属键越强,金属的硬度越大、熔点越高;该晶胞中顶点的原子按计,面上的原子按计。(3)[Cu(NH3)4]2+中Cu2+和NH3之间形成配位键,NH3内形成极性共价键。[Cu(NH3)4]2+的立体构型可以参照甲烷的立体构型考虑,若为正四面体形,则[Cu(NH3)4]2+中的两个NH3被两个Cl-取代后所得配合物只有一种,若为平面正方形则[Cu(NH3)4]2+中的两个NH3被两个Cl-取代后所得配合物有两种。
答案 (1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)晶体中铜的金属键强度大于钙的 1∶5
(3)①AC ②平面正方形
9.(14分) (2013.资阳联考)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式________________________________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂 化方式是________。
化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d, NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
解析 (1) 根据洪特规则的特例,d轨道半充满时更稳定,其Cr原子电子排布式是1s22s22p63s23p63d54s1而不是1s22s22p63s23p63d44s2。
根据洪特规则的特例,d轨道半充满时更稳定,其Cr原子电子排布式是1s22s22p63s23p63d54s1而不是1s22s22p63s23p63d44s2。
(2)SiO2硅氧之间的共价键是“头对头”的方式,所以是σ键,其中Si的杂化方式是sp3杂化。
(3)由分摊法计算:8×+6×=4;该晶胞的质量m=4×,该晶胞的体积V=3=16d3,晶胞密度ρ==。
答案 (1)1s22s22p63s23p63d54s1或[Ar]3d54s1 (2)σ键或极性共价键 sp3杂化 (3)4
10.(15分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为_____________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);

(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的 化学式为________。
化学式为________。
解析 (1)核外电子排布式与价电子排布式要区别开。
(2)NiO、FeO都属于离子晶体,熔点高低受离子键强弱影响,离 子半径越小,离子键越强,熔点越高。(3)因为NiO晶体结构类型与NaCl相同,而NaCl晶体中Na+、Cl-的配位数都是6,所以,NiO晶体Ni2+、O2-的配位数也是
子半径越小,离子键越强,熔点越高。(3)因为NiO晶体结构类型与NaCl相同,而NaCl晶体中Na+、Cl-的配位数都是6,所以,NiO晶体Ni2+、O2-的配位数也是 6。(4)根据晶胞结构可计算,一个合金晶胞中,La:8×=1,Ni:1+8×=5。所以该合金的化学式为LaNi5。
6。(4)根据晶胞结构可计算,一个合金晶胞中,La:8×=1,Ni:1+8×=5。所以该合金的化学式为LaNi5。
答案 (1)[Ar]3d84s2或1s22s22p63s23p63d84s2
(2)> (3)6 6 (4)LaNi5
11.(15分) (2013.攀枝花模拟)可以由下列反应合成三聚氰胺:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____________________________________________。
CaCN2中阴离子为CN,与CN互为等电子体的分子有N2O和________(填化学式),由此可以推知CN的空间构型为________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________。
 (3)三聚氰胺(
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________。CaO晶体和NaCl晶体的晶格能分别为:CaO 3 401 kJ.mol-1、NaCl 786 kJ.mol-1。导致两者晶格能差异的主要原因是__________________________________________________________________________________________________________________________________________。
解析 (1)Ca的最外层是2个电子,与它同一周期的元素在第四周期,内层排满电子则K到M层分别为2、8、18个电子,则它的基态原子的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;与CN互为等电子体,必须符合原子数相等,价电子总数相等,故可以是CO2,因为CO2是直线形分子,则CN的空间构型是直线形。(2)尿素分子的结构简式为 ,分子中的C原子采用sp2杂化方式,碳氧之间的共价键有1个σ键、1个π键。(3)三聚氰酸与三聚氰胺分子之间通过分子间氢键相互结合而形成结石。(4)由晶胞图可看出,1个Ca2+周围有6个O2-,则晶体中Ca2+的配位数为6;CaO晶体的晶格能远大于NaCl晶体的晶格能的原因是CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。
,分子中的C原子采用sp2杂化方式,碳氧之间的共价键有1个σ键、1个π键。(3)三聚氰酸与三聚氰胺分子之间通过分子间氢键相互结合而形成结石。(4)由晶胞图可看出,1个Ca2+周围有6个O2-,则晶体中Ca2+的配位数为6;CaO晶体的晶格能远大于NaCl晶体的晶格能的原因是CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。
答案 (1)1s22s22p63s23p63d104s2或[Ar]3d104s2 CO2 直线形 (2)sp2  (3)分子间氢键
(3)分子间氢键
(4)6 CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量