
1.下列关于人体免疫的说法正确的是( )
A.巨噬细胞内的溶酶体将细菌抗原降解为氨基酸
B.HIV病毒表面的包膜及蛋白是其自身基因的表达产物
C.细胞毒性T淋巴细胞能识别内环境中游离的病毒
D.癌细胞表面的MHC发生改变,可以被人体免疫系统识别
2.某培养液中的小鼠离体神经纤维受到适宜刺激后,膜内钠离子含量变化及膜电位变化如图所示。下列有关说法不正确的是( )

A.适当提高培养液中钠离子浓度可以提高曲线Ⅱ上C
点值
B.b时,膜内钠离子浓度小于膜外
C.该实验中某溶液可以用适当浓度的KCl溶液代替
D.图中Ⅱ曲线中的cd段,钾离子通过易化扩散进入
神经细胞
3.植物叶片的脱落与激素调节有关。其中叶柄离层的远基端(远离茎的一侧)和近基端(靠近茎的一侧)的生长素含量与叶片脱落的关系如下图所示。据图及相关知识判断下列叙述错误的是( )
 A.生长素是在幼叶中合成的,生长素的运输方式为扩散
A.生长素是在幼叶中合成的,生长素的运输方式为扩散
B.叶片接近脱落时,脱落酸可能促进离层细胞分泌纤维素酶和果胶酶
C.叶片的脱落与否取决于远基端和近基端生长素的相对浓度
D.叶片脱落是多种激素共同调节的结果
4.下图为真核细胞内的蛋白质合成示意图,表格中为可能用到的遗传密码与相应氨基酸,以下说法错误..的

A.mRNA在细胞核内加工成熟后再转移到细胞质中
B.核糖体能认读mRNA上决定氨基酸种类的密码
C.tRNA的形成过程不属于基因的表达
D.氨基酸1和2分别为丙氨酸和丙氨酸
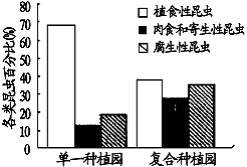
5.为防治苹果椿象等植食性害虫,有人尝试在苹果园的株间 种植矮小的白三叶草,将苹果单一种植园改造成苹果-白三叶草复合种植园,改造前后一定时期内对植物园中各类昆虫种群数量进行调查统计,右图为各类昆虫所占的数量百分比。以下相关叙述正确的是( )
A.可采用标志重捕法调查昆虫卵的数量
B.改造后肉食和寄生性昆虫数量比例增加可能与植食性昆虫种类增加有关
C.复合种植园中植食性害虫明显减少,不利于生态系统的稳态维持
D.改造后各种群数量的变化主要由内源性因素引起
6.下图表示用胸苷(TdR)双阻断法使细胞周期同步化,其中A表示正常的细胞周期,G1 、S 、G2、 M期依次分别为10h、7h、3.5 h、1.5h;B表示经第一次阻断,细胞都停留在S期;C表示洗去TdR恢复正常的细胞周期;D表示经第二次阻断,细胞均停留在G1/S交界处。下列说法正确的是( )

A.实验中需要对细胞解离,漂洗,染色,制片,以便于显微镜下观察
B.胸苷(TdR)很可能是通过阻碍核糖体与mRNA结合发挥作用的
C.第二次阻断应该在第一次洗去TdR之后的7h到15h之间
D.若改用秋水仙素处理,则细胞会停留在G2/M交界处
29.(15分)过氧化钙常用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂。在食品、牙粉、化妆品等制造中广泛使用。查阅资料:过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl 实验步骤、反应装置如图所示,请回答下列问题:

(1)仪器X的名称 ▲ 。
(2)加入氨水的作用是 ▲ 。
(3)该合成反应生成沉淀的过程中,关键是控制温度,其合理的措施是 ▲ 。
A.冰水浴 B.不断搅拌
C.逐滴滴加CaCl2溶液 D.直接加CaCl2固体,而不用其溶液滴加
(4)① 过滤后洗涤沉淀的试剂最好用 ▲ 。
A.热水 B.冷水 C.乙醇 D.乙醚
② 如何判断沉淀已经洗涤干净 ▲ 。
(Ⅱ)产品稳定性分析:取I中所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000 mol.L-1酸性高锰酸钾溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如下表
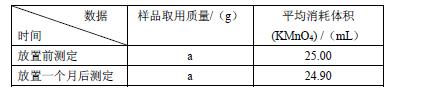
已知:a.H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解。
b.产品稳定性=(放置一个月后CaO2的质量分数/放置前CaO2的质量分数)×100%
(5)用KMnO4滴定,达到滴定终点时的现象是 ▲ 。
(6)该产品的―产品稳定性‖= ▲ 。
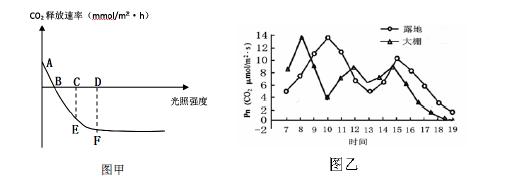
30.(14分)已知某植物X比曙光油桃能利用更低浓度的CO2,图甲表示该植物在最适温度及其他条件保持不变的条件下叶片CO2释放速率随光照强度变化的曲线,图乙表示曙光油桃在6月晴朗天气下露地栽培和大棚栽培光合速率(Pn)的日变化。回答下列相关问题:
(1)光合作用中NADPH中的氢来自于 ▲ (填写物质)。
(2)图甲中C点骤变为____▲____点时,短时间内叶肉细胞中3-磷酸甘油酸的含量将快速下降。此时胞间CO2浓度将____▲___(升高、不变、下降)。
(3)若其他条件不变,温度上升5℃则图甲中E点将向____▲____方向移动。
(4)露地栽培条件下,曙光油桃在13 时左右出现“午休”现象。此时,同条件下栽培X ▲ (“会”或者“不会”)出现明显的“午休”现象
(5)据图乙中曲线分析,提高大棚栽培曙光油桃的产量措施有 ▲ 。
(6)为了延长曙光油桃生长后期叶片的寿命,可向叶面喷洒的植物激素是____▲____。
31.(12分)已知甲药和乙药分别促进和抑制蛙心跳动。请根据以下材料和用具设计实验,验证甲药和乙药的作用效果,并回答有关问题。
材料和用具:离体蛙心灌注实验装置一个(装置中有一个蛙心,有记录蛙心跳动情况的装置和插管,蛙心内溶液已全部换成任氏液),滴管,任氏液,适宜浓度的甲药液,适宜浓度的乙药液等。
(注:任氏液是一种接近蛙内环境的液体;实验过程中心脏均能保持活性,甲、乙两药用药量、用药方法不做要求,实验过程中药效稳定,且心脏本身代谢不产生甲药与乙药)。
(1)该实验的自变量是: 。
(2)补充下列实验设计思路:
① 。
②往蛙心插管的任氏液中加2滴甲药液,观察并记录蛙心率
③ 。
④ 。
(3)在如下坐标系中画出预期实验结果。(要注明用药时间)

32.(18分)果蝇(2N=8)是良好的遗传学材料,其展翅和卷翅是由Ⅲ号常染色体上一对等位基因(D、d)控制,红眼与白眼这对相对性状的遗传属于伴性遗传。一对展翅果蝇相互交配,其子一代展翅和卷翅之比为2:1。请回答下列相关问题:
(1)等位基因(D、d)的形成是由于 ▲ 结果。
(2)子一代性状分离比为2:1的原因是 ▲ 。
(3)让子一代自由交配,子二代中卷翅所占比例为 ▲ ,如果让这个品系一直自由交配下去, ▲ 基因频率将会越来越小,直至消失。
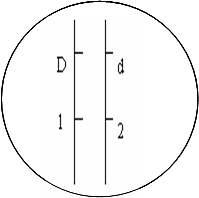
(4)为了保存可能会消失的基因,人们发现可以在果蝇体内Ⅲ号染色体
导入另一个基因B(纯合致死,且不影响翅型)以达到保存的目的。
那么应把B基因导入右图所示的 ▲ 位置(填图中相应的
数字),并且在形成配子过程中不发生交叉互换。用遗传图解解释该
基因得以保存的原因(无B基因的用b代替)。
(5)若展翅白眼雌果蝇和展翅红眼雄果蝇杂交,预测其后代的基因型种
类和表现型种类依次为 ▲ , ▲
2016 届浙江省六校联考
理科综合答案
1.D 2.C 3.A 4.C 5.B 6.C 29、(1)冷凝管(或球形冷凝管)(2分)
(2)中和反应生成的HCl,使CaCl2+H2O2⇌CaO2+2HCl向右进行(2分)
(3) ABC (3分)
(4)①B (2分)
②取最后一次洗涤液,滴加硝酸酸化的硝酸银,若未出现白色沉淀,则已洗涤干净。(2分)
(5)溶液由无色变紫色,且半分钟不褪色(2分)
(6)99.60% (2分)
30.每空2分,共14分
(1)水
(2)D 下降(3)上
(4)不会
(5)适当提高二氧化碳浓度、适当增加光照强度(写全才给分)
(6)细胞分裂素
31.共12分,(3)4分,其余每空2分
(1)是否加入甲药;是否加入乙药(写“是否用药”不给分)
(2)①观察并记录正常情况下(用药前)蛙的心率
③将蛙心插管中含甲药液任氏液全部吸出,再滴入任氏液,观察并记录蛙心率
④往蛙心插管的任氏液中加2滴乙药液,观察并记录蛙心率
(3)
32. 共18分,其中(4)的遗传图解为4分,其余每空2分
共18分,其中(4)的遗传图解为4分,其余每空2分
(1)基因突变
(2)显性纯合致死(基因型为DD的个体致死/死亡)
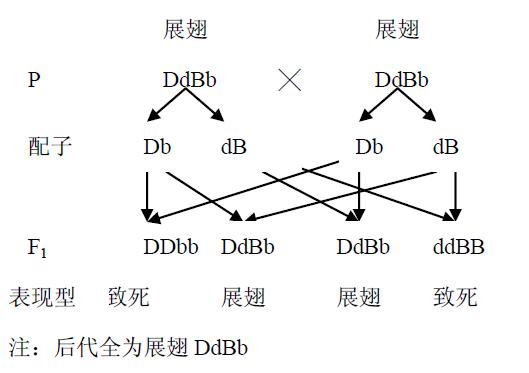 注:后代全为展翅DdBb
注:后代全为展翅DdBb
(4)2
遗传图解:
(5)4 4
2016届浙江省六校联考
理科综合试题卷
可能用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23,S-32,K-39,Ca-40,Mn-55,Fe-56,Cu-64,Pb-207
7.下列有关说法不正确...的是
A.羊毛、棉花、淀粉都是自然界存在的天然高分子化合物
B.生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质
C.霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系
D.一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热
8.下列说法正确的是
A.实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要大一些
B.用玻璃棒蘸取高锰酸钾溶液,滴在pH试纸上,然后与标准比色卡对照,测定其pH
C.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液
D.容量瓶、滴定管使用前均需检漏,并需要润洗以减小实验误差
9.X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子,Y与M形成的气态化合物在标准状况下的密度为0.76 g.L-1,W在短周期主族元素中原子半径最大。下列说法不正确...的是
A.原子半径:W>Y>M
B.由X、Y、Z、M 四种元素形成的化合物一定既有离子键,又有共价键
C.W 和Z 形成的常见化合物中阴、阳离子物质的量之比均为1∶2
D.由X 元素形成的单质晶体不一定是原子晶体
10.下列说法正确的是
A.按系统命名法,化合物
 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛
C.用甘氨酸[H2N-CH2-COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽
D.乙醇、乙二醇、丙三醇的沸点依次升高
11.右图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是

A.正极反应式为MnO2+4H++2e-===Mn2++2H2O
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.若用该电池给铅蓄电池充电,MnO2 电极质量减少8.7g,则铅蓄电池阴极增重9.6 g
12.25℃时,已知
现取10.6 g Na2CO3 与盐酸混合所得的一组体积为1 L 的溶液,溶液中部分微粒与pH 的关系如图所示。在25℃时,下列有关溶液中离子浓度关系叙述正确的是

A.W 点所示的溶液中:
c(Na+) + c(H+) = 2c(CO32-) + c(OH-) + c(HCO3-)
B.pH = 4 的溶液中:
c(H2CO3) + c(HCO3-) + c(CO32-) = 0.1 mol.L-1
C.pH=8 的溶液中:
c(H+) + c(H2CO3) + c(HCO3-) = c(OH-) + c(Cl-)
D.pH=11 的溶液中:CO32-+ H2O HCO3-+ OH- K ≈2.5×l0-4
13.CuCl 是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2.CuCO3, 含FeS、FeO 和SiO2 杂质)制备CuCl 的某流程如下
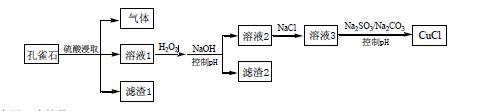
下列说法不正确...的是
A.H2O2 将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3 除去
B.CO32-作用是控制溶液pH,促使CuCl 沉淀的生成
C.SO32-将溶液3 中的Cu2+还原,反应得到CuCl
D.若改变试剂加入顺序,将溶液3 缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl
26.(10 分) 以乙炔为原料在不同条件下可以合成多种有机物。
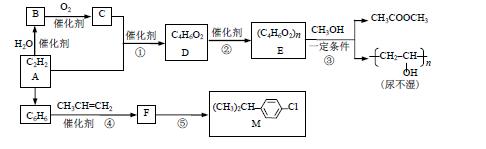
已知:
完成下列填空:
(1)B 中官能团名称 ▲ ;④的反应类型 ▲ 。
(2)⑤的反应条件 ▲ 。
(3)③的化学方程式 ▲ 。
(4)D 的同分异构体中含碳碳双键、能发生银镜反应且属于酯的共有 ▲ 种。
27.Ⅰ.(6分) 请回答:
(1)Na2O2的电子式 ▲ 。
(2)溶解在水中的O2在碱性条件下可以将Mn2+氧化成MnO(OH)2,写出该反应的离子方程式 ▲ 。
(3)工业上常通过高温分解FeSO4的方法制备Fe2O3,用化学方程式表示其原理 ▲ 。
II.(12分) 电镀工业中往往产生大量的有毒废水,必须经过严格处理后才可以排放。某种含A离子(阴离子)废水在排放前的处理过程如下:

已知:9.0 g沉淀D在氧气中灼烧后,产生8.0 g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25 g.L-1的气体E 1.12 L。
(1)E的结构式 ▲ 。
(2)沉淀D的化学式 ▲ 。
(3)写出沉淀D在氧气中灼烧发生的化学方程式 ▲ 。
(4)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 ▲ 。
(5)反应①为制得某种元素的低价X离子,试从氧化还原反应......的角度分析,是否可以用Na2SO3溶液来代替B溶液,说明理由 ▲ ,
并设计实验方案证明Na2SO3溶液是否变质 ▲ 。
28.(15分)近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上。已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。
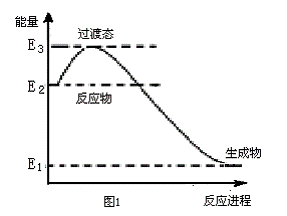
(1)催化剂存在时用H2将NO还原为N2。
图1是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图, 写出该反应的热化学方程式 ▲ 。(ΔH用E1、E2、E3表示)
(2)工业上可采用CO和H2合成甲醇,发生反应为
(I)CO(g)+2H2(g)CH3OH(g) △H<0
在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个...条件后,下列变化能说明平衡一定..向正反应方向移动的是 ▲ 。
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大 D. 反应物的体积百分含量增大
E. 混合气体的密度减小 F. 氢气的转化率减小
(3)在汽车上安装三元催化转化器可实现反应:(Ⅱ)2NO(g)+2CO(g)N2(g)+2CO2(g) △H<0 。则该反应在 ▲ (填―高温‖、―低温‖或―任何温度‖)下能自发进行。
(4)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。

以下说法正确的是 ▲
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.两种催化剂分别适宜于55℃和75℃左右脱氮
(5)在某温度下,2 L密闭容器中充入NO、CO各0.4 mol进行反应(Ⅱ),测得NO物质的量变化如图3所示,5分钟末反应达到平衡,该反应的平衡常数K= ▲ 。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图3中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线。
图3

(6)NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx脱氮转化成无毒的N2,减少对大气的污染。下列物质可能作为脱氮剂的是 ▲
A.NH3 B.CH4 C.KMnO4 D.尿素
2016 届浙江省六校联考
理科综合答案
7.B 8.C 9.B 10.D 11.A 12.D 13.D
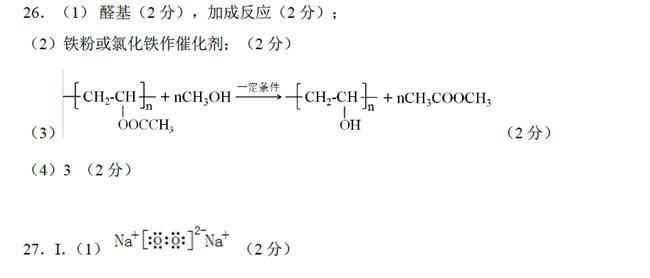
 取少量Na2SO3溶液,先加入BaCl2溶液,再加入足量稀盐酸,观察有无沉淀。若有,说明Na2SO3溶液已变质(2分,其他合理答案也给分)
取少量Na2SO3溶液,先加入BaCl2溶液,再加入足量稀盐酸,观察有无沉淀。若有,说明Na2SO3溶液已变质(2分,其他合理答案也给分)
或取少量Na2SO3溶液,先加入足量稀盐酸,再加入BaCl2溶液,观察有无沉淀。若有,说明Na2SO3溶液已变质
28、(1)2H2(g)+2NO(g)N2(g)+2H2O (g) ΔH =2(E1-E2)kJ.mol-1 (2分)
(2)AC (2分) (3)低温(2分) (4)D (2分)
(5) 5(2分) 作图如右所示(2分)
(6)A、B、D(3分,1分1个)
29、(1)冷凝管(或球形冷凝管)(2分)
(2)中和反应生成的HCl,使CaCl2+H2O2⇌CaO2+2HCl向右进行(2分)
(3) ABC (3分)
(4)①B (2分)
②取最后一次洗涤液,滴加硝酸酸化的硝酸银,若未出现白色沉淀,则已洗涤干净。(2分)
(5)溶液由无色变紫色,且半分钟不褪色(2分)
(6)99.60% (2分)
2016届浙江省六校联考
理科综合试题卷
可能用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23,S-32,K-39,Ca-40,Mn-55,Fe-56,Cu-64,Pb-207
14.频闪照相是每隔相等时间曝光一次的照相方法,在同一张相片上记录运动物体在不同时刻的位置。如图所示是小球在竖直方向运动过程中拍摄的频闪照片,相机的频闪周期为T, 利用刻度尺测量相片上2、3、4、5 与1 位置之间的距离分别为x1、x2、x3、x4。下列说法正确的是( )

A.小球一定处于下落状态
B.小球在2 位置的速度大小为
C.小球的加速度大小为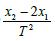
D.频闪照相法可用于验证机械能守恒定律
15.如图所示,平行板电容器PQ 两板加一恒定电源,Q 板上有两小孔A、B。一带电粒子从小孔A 以一定的初速度射入平行板P 和Q 之间的真空区域,经偏转后打在Q 板上如图所示的位置。在其它条件不变的情况下要使该粒子能从Q 板上的小孔B 射出,下列操作中可能实现的是(不计粒子重力)( )

A.保持开关S 闭合,适当下移P 极板
B.保持开关S 闭合,适当上移P 极板
C.先断开开关S,再适当下移P 极板
D.先断开开关S,再适当上移P 极板
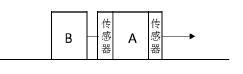
16.大家知道,在环绕地球运动的航天器是处于完全失重的状态,不能利用天平称量物体的质量。当力一定时,物体的质量越大,加速度就越小,根据牛顿第二定律能得出物体的质量。如图所示,已知标准物A 的质量为m1,连接在标准物A 前后的力学传感器的质量均为m2,待测质量的物体B 连接在后传感器上,在某一外力作用下整体在空间站内的桌面上运动,稳定后前后传感器的读数分别为F1、F2,由此可知待测物体B 的质量为( )

17.北京时间2015 年12 月22 日9 时29 分,美国太空探索公司(SpaceX)成功发射新型火箭Falcon 9 FT, 并在发射10 分钟后非常完美地回收了一级火箭,并成功将Orbcomm 公司的11 颗通讯卫星送入预定轨道。一级火箭的回收将大幅降低火箭发射费用,人类前往太空不再昂贵,廉价太空时代即将到来。如图为火箭通过尾部喷气正竖直向着降落平台减速降落的情景。火箭质量为m,喷出气体的质量相对于火箭质量很小, 在离平台高h 时速度为v,降落过程中受空气的浮力和阻力大小之和为Ff, 刚要落在平台上时的速度可忽略,降落过程中各力均可视为恒定。下列关于上述过程的描述正确的是( )

A.火箭处于失重状态
B.降落过程中喷气推力为
C.火箭的机械能减少了Ff h
D.火箭的重力势能减少了mgh
18.竖直平面内存在一正方形区域ABCD,边长为L,AC 为对角线,一带电粒子质量为m,电荷量为+q,重力不计,以水平初速度为从A 点射入正方形区域,可在ACD 区域内加竖直方向的匀强电场或垂直平面的匀强磁场,使得带电粒子能从C 点射出场区域, 则下列说法正确的是( ) 0 v

A.可在ACD 区域加竖直向下的匀强电场
B.可在ACD 区域加垂直平面向里的匀强磁场
C.加电场后从C 点射出与加磁场后从C 点射出所需时间之比为1: 2
D.所加电场的电场强度和磁场的磁感应强度之比为2v0:1
19.如图所示,木板 C 放在水平地面上,木板B 放在C 的上面,木板A 放在B 的上面,A 的右端通过轻质弹簧秤固定在竖直的墙壁上,A、B、C 质量相等,且各接触面动摩擦因数相同,用大小为F 的力向左拉动C,使它以速度v 匀速运动,三者稳定后弹簧秤的示数为T。则下列说法正确的是( )
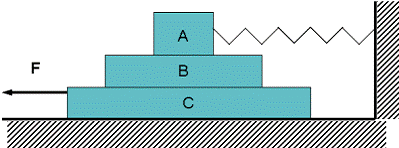
A.B 对A 的摩擦力大小为T,方向向左
B.A 和B 保持静止,C 匀速运动
C.A 保持静止, B 和C 一起匀速运动
D.C 受到地面的摩擦力大小为F-T
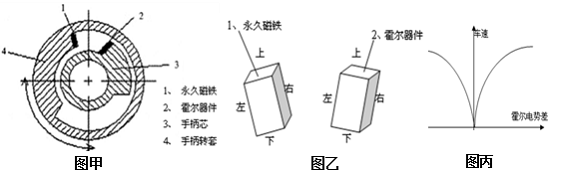
20.电动自行车是一种应用广泛的交通工具,其速度控制是通过转动右把手实现的,这种转动把手称“霍尔转把”,属于传感器非接触控制。转把内部有永久磁铁和霍尔器件等,截面如图甲。开启电源时,在霍尔器件的上下面之间加一定的电压,形成电流,如图乙。转把转动永久磁铁也跟着转动,霍尔器件能输出控制车速的电势差,已知电势差与车速关系如图丙,以下关于“霍尔转把”叙述正确的是( )
A.为提高控制的灵敏度,永久磁铁的上下端分别为N、S 极
B.按图甲顺时针转动把手,车速变快
C.图乙中从霍尔器件的左右侧面输出控制车速的电势差
D.若霍尔器件的上下面之间所加电压正负极性对调,不影响车速控制
21. (10 分)(1)小张同学用如图所示装置探究做功与物体速度变化的关系。
①所需器材如下:长木板、小车、橡皮筋、电火花计时器、纸带、毫米刻度尺等。电源的规格应该是 ▲ 。
②实验中甲、乙两同学用两种不同的方法来实现橡皮筋对小车做功的变化。
甲同学:通过改变橡皮筋的形变量来实现做功的变化;
乙同学: 把多条相同的橡皮筋并在一起,并把小车拉到相同位置释放。

你认为_ ▲ __(填“甲”或“乙”)同学的方法可行。
③请写出对实验结果产生影响的原因: ▲ 。
(2)小王同学用如图所示的装置探究加速度与力、质量的关系。
①下列说法正确的是 ▲
A.平衡摩擦力的实质是小车及砝码总的重力沿木板方向的分力与木板与小车间、纸带与计时器间、绳与滑轮间、滑轮与轴间的摩擦力平衡
B.平衡摩擦力的实质是小车及砝码总的重力沿木板方向的分力与小车和纸带所受的摩擦力平衡
C.平衡摩擦力的办法是反复调节砂桶中重物的多少和木板下所垫木块的厚度、位置
D.小车上的砝码改变质量时不需要重新调节木板倾斜度
E.平衡摩擦力要达到的标准是在砂桶的牵引下小车带动纸带从长木板的一端向有定滑轮的另一端做匀速直线运动
F.取下细绳,若小车拖着纸带沿长木板滑下时,打点计时器在纸带上打的点痕的距离是均匀的,就算是完成了平衡摩擦力
②在实验所得到的纸带上,每隔四个点取一个计数点,图中标出了5个计数点。所用交流电频率为50Hz,纸带旁边并排放着毫米刻度尺,零刻度线跟0计数点对齐,根据放大图计算小车的加速度大小为 ▲ m/s2。

22. (10分)某研究性学习小组的同学们来到电学实验室测量电源电动势和内电阻。
大家分别选用不同的实验器材设计了以下四种测量电路:

⑴上面测量电路中,不能够完成实验目的的是哪一个电路? ▲ 。 ⑵小明同学根据其中的一个电路直接测得的实验数据作出了下表。
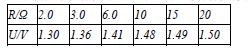
①由此可知该同学选用的是 ▲ 图所示的电路进行的实验。
②采用图像法处理数据时,小明想作出U-R图线,并由该图线得出电源电动势和内阻。他的这种想法是否合理? ▲ 。如果合理请说明理由;如果不合理请给出合理的建议。
▲ 。
23.(16分)嘉年华上有一种回力球游戏,如图所示,A、B分别为一固定在竖直平面内的光滑半圆形轨道的最高点和最低点,B点距水平地面的高度为h,某人在水平地面C点处以某一初速度抛出一个质量为 m的小球,小球恰好水平进入半圆轨道内侧的最低点B,并恰好能过最高点A后水平抛出,又恰好回到C点抛球人手中。若不计空气阻力,已知当地重力加速度为g,求:
(1)小球刚进入半圆形轨道最低点B时轨道对小球的支持力;
(2)半圆形轨道的半径;
(3)小球抛出时的初速度大小。

24.(20分)如图(a)为一研究电磁感应的实验装置示意图,其中电流传感器(电阻不计)能将各时刻的电流数据实时通过数据采集器传输给计算机,经计算机处理后在屏幕上同步显示出I-t图像。平行且足够长的光滑金属轨道的电阻忽略不计,左侧倾斜导轨平面与水平方向夹角θ=30°,与右侧水平导轨平滑连接, 轨道上端连接一阻值R=0.5Ω的定值电阻,金属杆MN的电阻r=0.5Ω,质量m=0.2kg,杆长L=1m跨接在两导轨上。左侧倾斜导轨区域加一垂直轨道平面向下的匀强磁场,右侧水平导轨区域也加一垂直轨道平面向下的匀强磁场,磁感应强度大小都为B= 1.0T, 闭合开关S,让金属杆MN从图示位置由静止开始释放,其始终与轨道垂直且接触良好,此后计算机屏幕上显示出金属杆在倾斜导轨上滑行过程中的I-t图像,如图(b)所示。 ( g取10m/s2)
图(a)
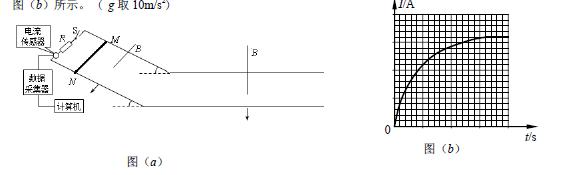
(1)求金属杆MN在倾斜导轨上滑行的最大速率;
(2)根据计算机显示出的I-t图像可知,当t=2s时,I=0.8A,0-2s内通过电阻R的电荷量为1.0C, 求0-2s内在电阻R上产生的焦耳热;
(3)金属杆MN在水平导轨上滑行的最大距离 。
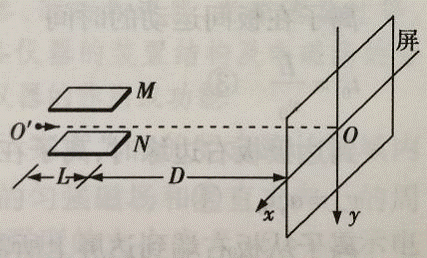
25.(22 分)质谱分析技术已广泛应用于各前沿科学领域, 如图所示是汤姆孙发现电子的质谱装置示意图,
M、N 为两块水平放置的平行金属极板,板长为L,板右端到屏的距离为D,O′O 为垂直于屏的中心轴线,
以屏中心O 为原点建立xOy 直角坐标系,其中x 轴沿水平方向,y 轴沿竖直方向。(带电粒子重力不计)
(1)设一个质量为m0、电荷量为q0 的正离子以速度v0(v0 很大,D 远大于L,不计带电粒子在板间运动
时偏离O'O 的距离)沿O′O 的方向从O′点射入,板间不加电场和磁场时,离子打在屏上O 点。
①若在两极板间加一个沿+y 方向场强为E 的匀强电场,求离子射到屏上时偏离O 点的距离y1;
②若在两极板间加一沿+x 方向磁感应强度为B 的匀强磁场,求离子射到屏上时偏离O 点的距离y2 ;
(在板间运动时O′O 方向的分速度总是远大于x 方向和y 方向的分速度;当q 很小时,tanq =sinq ,cosq =1)
(2)在上述装置中,保留第(1)问中的电场,再在板间加沿-y 方向的匀强磁场。现有电荷量相同的两种正
离子组成的离子流,仍从O′点沿O′O 方向射入(入射速度各有不同,但都很大,且在板间运动时O′O 方
向的分速度总是远大于x 方向和y 方向的分速度),屏上出现两条亮线。在两线上取y 坐标相同的两个光点,
对应的x 坐标分别为4.32mm 和4.00mm,其中x 坐标大的光点是碳12 离子击中屏产生的,另一光点是未
知离子产生。试依照以上实验结果计算未知离子的质量数(取两位有效数字).
2016 届浙江省六校联考
理科综合答案
14. D 15.B 16. C 17. D 18. ACD 19. ACD 20.BD
21.(10 分)
(1)①220V 交流电 (2 分)(只写220V 或交流电给1 分)
②乙 (2 分)
③平衡摩擦力过度或不足产生影响;所用橡皮筋不完全相同产生影响;测量纸带上各点间距时产生误差带来影响。(2 分)(以上写出一条即可得2 分,其它合理答案也给分)
(2) ①BDF (2 分) (少选给1 分,错选不得分)
②0.6 (2 分)
22. (10 分)
(1)丙 (3 分)
(2)①丁 (3 分)
②不合理(2 分)

