
1.下列说法错误的是
A.一定温度下,弱酸的电离常数越大,酸性越强
B.醋酸的电离常数K。和醋酸钠的水解常数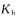 之间的关系为:
之间的关系为: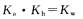
C.平衡常数只受温度影响,与反应物或生成物的浓度变化无关
D.合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同
2.下列方程式正确的是
A.向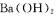 溶液中滴加NaHS04溶液至中性:
溶液中滴加NaHS04溶液至中性: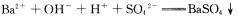
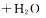
B.硫化钠溶液显碱性的原因:
C.向碳酸钠溶液中通入少量的二氧化硫:
D.氧化亚钦溶于稀硝酸中:
3.下列说法中,不正确的是 ( )
A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种
B.第三周期元素的离子半径大小比较:
C.日本福岛核电站释放出的放射性核素 互为同位素
互为同位素
D.相同条件下,通过测定同浓度的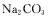 溶液和
溶液和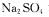 溶液的pH,可比较C和S的非金属性强弱
溶液的pH,可比较C和S的非金属性强弱
4.下列说法正确的是 ( )
A.已知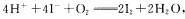 ,现使用1 mol/L
KI溶液、0.1 mol/L,硫酸和淀粉溶液探究溶液出现蓝色的时间与温度的关系,应先将1 mol/L KI溶液、0.1 mol/L,硫酸混合,升温后再加入淀粉溶液
,现使用1 mol/L
KI溶液、0.1 mol/L,硫酸和淀粉溶液探究溶液出现蓝色的时间与温度的关系,应先将1 mol/L KI溶液、0.1 mol/L,硫酸混合,升温后再加入淀粉溶液
B.将稀氯化铁溶液和稀硫氰化钾溶液混合,溶液呈浅红色,无论向其中加入浓氯化铁溶液还是
浓硫氰化钾溶液,红色都会加深
C.向0.1 mol/L的醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体生成
D.实验测定酸碱滴定曲线时.要保证整个过程测试和记录pH的间隔相同
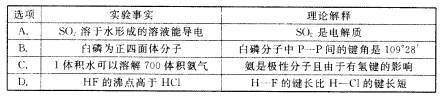
5.下列对一些实验事实的理论解释正确的是
6.硫代硫酸钠溶液与稀硫酸反应的化学方程式为: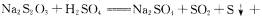
下列各组实验中最先出现浑浊的是 ( )

7.某溶液中可能含有下列离子: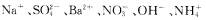 中的某几种离子,为确定该溶液的组成,某同学做了如下实验:
中的某几种离子,为确定该溶液的组成,某同学做了如下实验:
(1)取少量上述溶液,向其中加入硫酸钠溶液,产生白色沉淀,加入稀硝酸沉淀不溶解;
(2)另取少量该溶液,向其中加入足量的NaOH溶液并加热,产生有刺激性气味的气体。则下列有关说法中不正确的是 ( )
A.该溶液中一定含有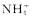 B.该溶液中一定含有硝酸根离子
B.该溶液中一定含有硝酸根离子
C.该溶液中一定含有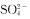 D.根据上述实验不能确定
D.根据上述实验不能确定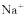 是否存在
是否存在
8.可逆反应 在不同温度及压强
在不同温度及压强 条件下反应物A的转化率的变化情况如图所示。下列判断正确的是 ( )
条件下反应物A的转化率的变化情况如图所示。下列判断正确的是 ( )

A.正反应吸热,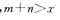 B.正反应吸热,
B.正反应吸热,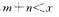
C.正反应放热,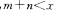 D.正反应放热,
D.正反应放热,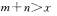
9.用 表示阿伏加德罗常数的值,下列叙述中正确的有几项 ( )
表示阿伏加德罗常数的值,下列叙述中正确的有几项 ( )
①106 g碳酸钠晶体中离子总数为3NA
②
③将2 ml.0.5 mol/L硅酸钠溶液滴入盐酸中制得硅酸胶体,所含胶粒数目为0.00NA
④某密闭容器中盛有0.1 mol氮气和0.1 mol氢气,一定条件下充分反应后转移的电子数为0.6NA
A.1项 B.2项 C.3项 D.4项
10.下列过程都与热量变化有关,其中表述正确的是 ( )

C.铝热反应是放热反应,因此不需要加热就能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
11.某温度下水的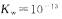 ,在此温度下,将
,在此温度下,将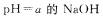 溶液
溶液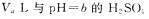 ;溶液
;溶液 混合,下列说法正确的是
混合,下列说法正确的是
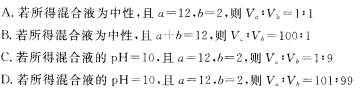
12.下列说法正确的是 ( )
A.稀释Na2CO3溶液时,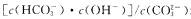 增大
增大
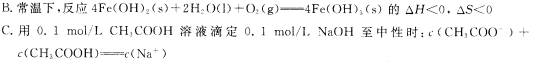
D.向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
13.做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸) 的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为

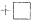 。下列有关叙述正确的是 ( )
。下列有关叙述正确的是 ( )
A.发生还原反应的是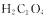 B.该离子方程式右侧方框内的产物是
B.该离子方程式右侧方框内的产物是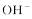
C. 草酸分子中含
草酸分子中含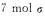 键 D.10 mol二氧化碳生成时,电子转移5 mol
键 D.10 mol二氧化碳生成时,电子转移5 mol
14.某温度下,密闭容器中,发生如下可逆反应: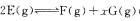 (正反应放热);若起始时E浓度为
(正反应放热);若起始时E浓度为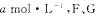 浓度均为0,达平衡时E浓度为
浓度均为0,达平衡时E浓度为 的起始浓度改为
的起始浓度改为 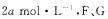 浓度仍为0,当达到新的平衡时,下列说法正确的是
(
)
浓度仍为0,当达到新的平衡时,下列说法正确的是
(
)
A.升高温度时,正反应速率加快,逆反应速率减慢
B.若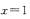 ,容器体积保持不变,新平衡下E的体积分数为50%
,容器体积保持不变,新平衡下E的体积分数为50%
C.若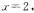 ,容器体积保持不变,新平衡下F的平衡浓度为
,容器体积保持不变,新平衡下F的平衡浓度为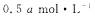
D.若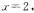 ,容器压强保持不变,新平衡下E的物质的量为
,容器压强保持不变,新平衡下E的物质的量为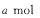
15.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
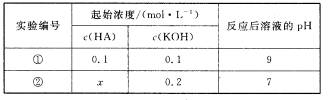
下列判断不正确的是 ( )
A.实验①反应后的溶液中: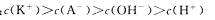
B.实验①反应后的溶液中: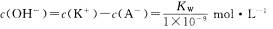
C.实验②反应后的溶液中: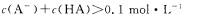
D.实验②反应后的溶液中: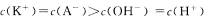
16.下列说法不正确的是 ( )
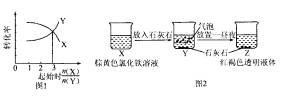
A.常温下,体积相等、pH都为3的盐酸和醋酸,中和氢氧化钠的能力,盐酸小于醋酸
B.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得
X、Y的转化率与起始两物质的物质的量之比的关系如图1所示,则该反应的方程式可以表
示为: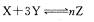
C.某同学在实验室进行了如图2所示的实验,则Y中反应的离子方程式为:

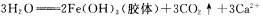
D.在25℃时,将以mol/l.的氨水与0.01 mol/L的盐酸等体积混合,反应完全时溶液中
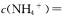
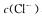 ,用含a的代数式表示完全反应时一水合氨的电离常数:
,用含a的代数式表示完全反应时一水合氨的电离常数:
17.下图所示与对应的叙述相符的是 ( )

A.图I表示盐酸滴加到0.1 mol/l/某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度 该碱时最好选取酚酞作指示剂
B.图Ⅱ表示一定条件下进行的反应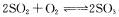 各成分的物质的量变化,
各成分的物质的量变化,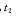 时刻改变 的条件可能是缩小容器体积
时刻改变 的条件可能是缩小容器体积
C.图Ⅲ表示某明矾溶液中加入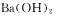 溶液,沉淀的质量与加入
溶液,沉淀的质量与加入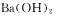 溶液体积的关系,在加入20 ml。
溶液体积的关系,在加入20 ml。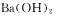 溶液时铝离子恰好沉淀完全
溶液时铝离子恰好沉淀完全
D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线以对应的是盐酸
18.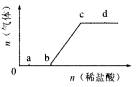 向
向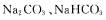 混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是
混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是
A.a点对应的溶液中: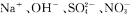
B.b点对应的溶液中: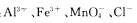
C.c点对应的溶液中: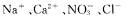
D.d点对应的溶液中: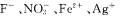
19.下列化合物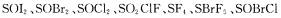 在水中容易水解,但不发生氧化还原反应,所有产物都是可溶的。现将其中的一种化合物A配成溶液,稀释后分成几份,分别加入一系列0.1 mol.L-l的试剂。(已知氟化钙难溶于水)列表如下:
在水中容易水解,但不发生氧化还原反应,所有产物都是可溶的。现将其中的一种化合物A配成溶液,稀释后分成几份,分别加入一系列0.1 mol.L-l的试剂。(已知氟化钙难溶于水)列表如下:
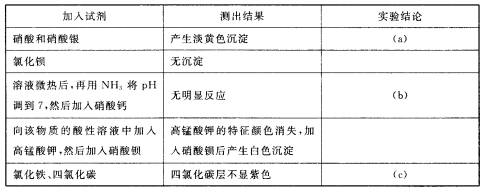
根据实验结果,下列实验结论不正确的是 ( )
A.实验结论
B.实验结论(b)排除F-
C.实验讨论(c)排除I-
D.该化合物的化学式是SOBr2
20.下列排列顺序完全正确的组合是 ( )
①溶解性:
③等浓度的下列盐溶液的pH关系: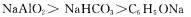
③常温下,以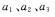 分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电
分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电
离程度,则a1 =a2>a3
④同温下,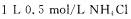 溶液中,
溶液中,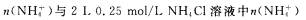
⑤热稳定性:
⑥半径: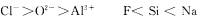
⑦氧化性: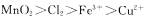
⑧沸点:金刚石>氯化钠>于冰>冰醋酸
A.①②③④⑥ B.①③④⑥⑦⑧
C.②⑤⑧ D.①④⑥⑦
21.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组
合是 ( )
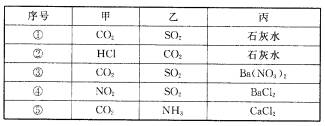
A.②③④ B.②③④⑤ C.①③④ D.①②③④
22.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):

下列计算结果错误的是 ( )
A.①中溶解了8.4 g Fe
B.原混合物总质量为105.6 g
C.硝酸的浓度为4 mol/L
D.④中V=6720
23.常温下,向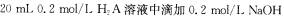 溶液。有关微粒的物质的量变化如下图(其中]代表H2A,Ⅱ代表HA--,Ⅲ代表A') -],根据图示判断,下列说法正确的是
(
)
溶液。有关微粒的物质的量变化如下图(其中]代表H2A,Ⅱ代表HA--,Ⅲ代表A') -],根据图示判断,下列说法正确的是
(
)
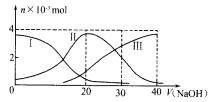

24.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
 .按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下
.按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下

下列说法不正确的是 ( )
A.容器乙中反应从开始到达平衡的反应速率为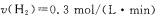
B.在该温度下甲容器中反应的平衡常数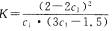

25.中学常见的某反应的化学方程式为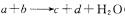 (未配平,反应条件略去)。下列叙述不正确的是 ( )
(未配平,反应条件略去)。下列叙述不正确的是 ( )
A.若a是铁,b是稀硝酸(过量)且以可溶于r溶液中。则n与6反应的离子方程式为

B.若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为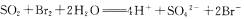
C.若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得
平均摩尔质量为20 g.mol-'1的混合气体进行喷泉实验。假设溶质不扩散,实验完成后所得
溶液的物质的量浓度约为0. 056 mol.L-1。
D.若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为
第Ⅱ卷(非选择题 共60分)
请将答案填写到答题纸的相应位置上
26.目前工业上可利用C()或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学 反应原理进行探究。已知在不同温度下的化学反应。平衡常数(K1、K2、K3)如下表所示:

请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K,、K:与K。之间的关系,则K3=
(用K1、K2表示);根据反应③判断 (填“较高”或“较低”)温度下有利于该反应自发进行。
(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有 (填字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻. 的浓度分别为
的浓度分别为

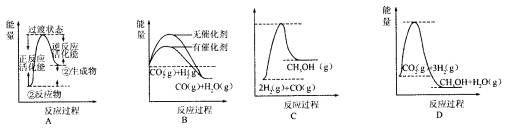
(5)根据上述表格测得焓变,下列能量关系图合理的是
27.纳米TiO22在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是 T1Cl4水解生成Ti0:.T H。(),经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体 T102。用氧化还原滴定法测定Ti()2的质量分数:一定条件下,将T102溶解并还原为T13 -, 以KSCN溶液作指示剂,用NH4Fe(S01)-2标准溶液滴定T13+至全部生成TiLr。
请回答下列问题:
(1) T1Cl4水解生成 的化学方程式为 。
的化学方程式为 。
(2)配制 标准溶液时,加入一定量
标准溶液时,加入一定量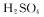 。的原因是 。使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外.还需要下图中的 (填字母代号)。
。的原因是 。使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外.还需要下图中的 (填字母代号)。

(3)滴定终点的现象是 。
(4)滴定分析时,称取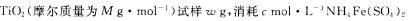
标准溶液V mL,则T1O2质量分数表达式为 。
(5)判断下列操作对rFi02质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的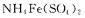 溶液有少量溅出,使测定结果
溶液有少量溅出,使测定结果
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果
28.合成氨是最重要的化工生产。
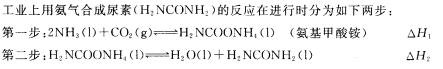
(1)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
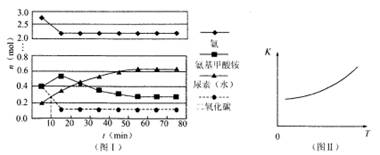
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 决定。

(3)合成氨盐也是氨的重要用途,测定其中的含氮量可以采用“甲醛法”。即
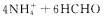
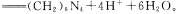 现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入
现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入 溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
29.“氢能”将是未来最理想的新能源。
1.实验测得,l克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为:
(填序号)

请根据绿色化学思想评价该方法的主要缺点是 。
Ⅲ.利周核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。
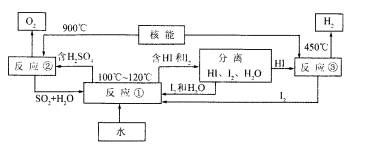
请写出化学方程式:
反应① 。
反应② 。
Ⅳ.氢气通常用生产水煤气的方法制得。其中
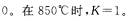
(1)若升高温度到950℃时,达到平衡时K 1(填“>”“-”或“=”)
(2)850℃时,若向一容积可变的密闭容器中同时充入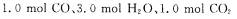
和x mol H2,则:
①当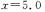 时,上述平衡向 (填正反应或逆反应)方向进行。
时,上述平衡向 (填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在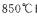 时,若设
时,若设 ,其它物质的投料不变,当上述反应达到平衡后,测得H?的体积分数分别为
,其它物质的投料不变,当上述反应达到平衡后,测得H?的体积分数分别为 。
。
30.X、Y是元素周期表前20号元素,且X的原子序数比Y大4。请填空:
I.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式 。
 (2)25℃,用0.1000 mol/I.XOH溶液滴定20.00 mL0.1000 mol/L某一元酸HA溶液所得滴定曲线如右图。下列说法芷确的是
。
(2)25℃,用0.1000 mol/I.XOH溶液滴定20.00 mL0.1000 mol/L某一元酸HA溶液所得滴定曲线如右图。下列说法芷确的是
。
A.A、B、C三点所示溶液导电能力最强的是C点对应的溶液
B.在C点溶液中: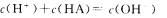
C.25℃,HA的电离平衡常数约为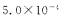
Ⅱ,若X的离子半径是第三周期离子半径最小的。
(3)已知在此温度下:

则HY和强碱稀溶液发生中和反应的热化学方程式为: 。
(Y要用具体的元素符号表示)
(4)X的单质与某磁性氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为 。
(II)若X为金属元素,Y为非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂。
(5)含X的某盐与Y的气态氧化物都能做漂白剂。写出制备X的某盐的化学方程式
31.过渡金属的离子具有很多不同的化合价,并且不同价态会有不同的颜色。钒离子的颜色尤其多。用锌瓶盛装含钒的溶液经常被用于化学演示,因为这溶液的颜色会随着钒元素的化合价态改变丽改变,分别变成黄色、蓝色、绿色、淡紫色等。

+2价钒离子(V+)经常被用于氧化还原滴定含Fe3+的未知浓度溶液,使在酸性环境中的Fe3+转变成Fe2+。
(1)请写出该反应的离子方程式 。
Fiona,一个年轻的分析化学家,决定配制0.r)00礅01.I,-l+2价钒离子的硫酸盐溶液(VS 0i),她用一瓶含结晶水的硫酸氧钒溶液( VOS04.2H2 0),但这溶液中溶解了夹杂少量水银催化剂的过量锌投。由于天色将晚,Fiona决定先把溶液过滤笄放置,以便第二天可以完成滴定。可是,事与愿违,Fiona发现她精心准每的淡紫色溶液,居然部分转变成了浅绿色。
(2)写出在空气中V 2’‘发生的可能反应
Fiona粗略地了解了一些原理后,决定用上图装置进行滴定。这个装置便于制取和存储v2,并且充满Hz以隔绝空气。
Fiona懂得很少量的溶解氧也能影响滴定效果。为了求得Fe3+溶液浓度,她往Fe抖溶液中滴加饱和Na:CO2溶液,生成红褐色沉淀;接着又滴加稀盐酸,产生了气泡。这些气泡用以赶跑溶液中很少量的溶解氧。
(3)写出生成红褐色沉淀可能的离子方程式 。
取25.00 rnL Fe2+。溶液用V,r标准溶液滴定。滴定过程中的指示剂为KSCN。所需标准液的体积平均为22.14 moL。
(4)Fe2+溶液的浓度为 mol//L。(计算结果保留3位有效数字)。
为了改进滴定的精确度,V川溶液用标准KMnO4溶液滴定。已知反应中

(5)写如 反应的离子方程式
。
反应的离子方程式
。

