
1.(2017.全国卷Ⅰ,13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
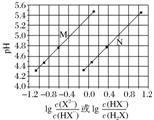
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
答案 D
解析 横坐标取0时,曲线M对应pH约为5.4,曲线N对应pH约为4.4,因为是NaOH滴定H2X溶液,所以在酸性较强的溶液中会存在c(HX-)=c(H2X),所以曲线N表示pH与lg的变化关系,B项正确;=1时,即lg=0,pH=5.4,c(H+)=1×10-5.4 mol.L-1,Ka2=≈1×10-5.4=100.6×10-6,A正确;NaHX溶液中,c(HX-)>c(X2-),即<1,lg<0,此时溶液呈酸性,C正确;D项,当溶液呈中性时,由曲线M可知lg>0,>1,即c(X2-)>c(HX-),错误。
2.(2017.江苏,14,改编)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3.H2O)=1.76×10-5,下列说法正确的是( )
A.浓度均为0.1 mol.L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol.L-1 HCOOH与0.1 mol.L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2 mol.L-1 CH3COONa与0.1 mol.L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
答案 A
解析 A项,由电荷守恒有c(Na+)+c(H+)=c(HCOO-)+c(OH-),c(Cl-)+c(OH-)=c(NH)+c(H+),因Kb(NH3.H2O)<Ka(HCOOH),同浓度的HCOONa和NH4Cl溶液,前者HCOO-水解程度小于后者NH的水解程度,即前者水解产生的c(OH-)小于后者水解产生的c(H+),有前者溶液中c(H+)大于后者溶液中c(OH-),c(Na+)=c(Cl-),有c(Na+)+c(H+) >c(Cl-)+c(OH-),正确;B项,CH3COOH的酸性比HCOOH弱,同pH时,c(CH3COOH)>c(HCOOH),用NaOH滴定时,CH3COOH消耗的NaOH多,错误;C项,此时为等浓度的HCOOH和HCOONa溶液,质子守恒式有c(HCOO-)+2c(OH-)=2c(H+) +c(HCOOH)[可由电荷守恒式c(Na+) +c(H+) =c(HCOO-)+c(OH-)和物料守恒式2c(Na+)=c(HCOO-)+c(HCOOH)处理得到],错误;D项,当两者等体积混合时,得等浓度CH3COOH、CH3COONa、NaCl的混合溶液,若不考虑CH3COOH的电离和CH3COO-的水解,有c(CH3COO-)=c(Cl-)=c(CH3COOH),溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,有c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),错误。
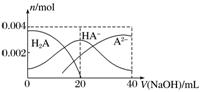
3.(2017.全国卷Ⅱ,12)改变0.1 mol.L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=]。
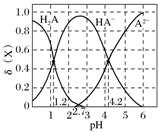
下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
答案 D
解析 A项,根据图像,pH=1.2时,H2A和HA-相交,则有c(H2A)=c(HA-),正确;B项,根据pH=4.2点,K2(H2A)==c(H+)=10-4.2,正确;C项,根据图像,pH=2.7时,H2A和A2-相交,则有c(H2A)=c(A2-),正确;D项,根据pH=4.2时,c(HA-)=c(A2-),且c(HA-)+c(A2-)约为0.1 mol.L-1,而c(H+)=10-4.2 mol.L-1,可知c(HA-)=c(A2-)>c(H+),错误。
角度一 溶液中的“三大平衡”及影响因素

电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡。这三种平衡都遵循勒夏特列原理——当只改变体系的一个条件时,平衡向能够减弱这种改变的方向移动。
1.电离平衡、水解平衡与沉淀溶解平衡的比较
|
|
电离平衡CH3COOH CH3COO-+H+ |
水解平衡(如CH3COONa溶液)CH3COO-+H2O CH3COOH+OH- |
沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq) |
|
|
研究 对象 |
弱电解质(包括弱酸、弱碱、水、多元弱酸的酸式酸根) |
盐溶液(包括强酸弱碱盐、弱酸强碱盐、弱酸弱碱盐) |
难溶电解质(如难溶的酸、碱、盐等) |
|
|
影响因素 |
升高温度 |
促进电离,离子浓度增大,Ka增大 |
促进水解,Kh增大 |
Ksp可能增大,也可能减小 |
|
加水稀释 |
促进电离,离子浓度(除OH-外)减小,Ka不变 |
促进水解,离子浓度(除H+外)减小,Kh不变 |
促进溶解,Ksp不变 |
|
|
加入相应离子 |
加入CH3COONa固体或盐酸,抑制电离,Ka不变 |
加入CH3COOH或NaOH,抑制水解,Kh不变 |
加入AgNO3溶液或NaCl溶液抑制溶解,Ksp不变 |
|
|
加入反应离子 |
加入NaOH,促进电离,Ka不变 |
加入盐酸,促进水解,Kh不变 |
加入氨水,促进溶解,Ksp不变 |
2.“电离平衡”分析判断中的常见误区
(1)误认为电离平衡正向移动,弱电解质的电离程度一定增大。如向醋酸溶液中加入少量冰醋酸,平衡向电离方向移动,但醋酸的电离程度减小。
(2)误认为弱电解质在加水稀释的过程中,溶液中离子浓度都减小。如氨水加水稀释时,c(H+)增大。
(3)误认为由水电离出的c(H+)=1.0×10-13 mol.L-1的溶液一定呈碱性。如25 ℃,0.1 mol.L-1盐酸或氢氧化钠溶液中由水电离的c(H+)都为1.0×10-13 mol.L-1。
(4)弱电解质溶液在加水稀释的过程中,判断某些微粒浓度的关系式是否发生变化时,首先要考虑该关系式是否是电离常数、离子积常数或者是它们的变形。
3.“水解平衡”常见的认识误区
(1)误认为水解平衡向正向移动,离子的水解程度一定增大。如向FeCl3溶液中加入少量FeCl3固体,平衡向水解方向移动,但Fe3+的水解程度减小。
(2)由于加热可促进盐类水解,错误地认为可水解的盐溶液在蒸干后都得不到原溶质。其实不一定,对于那些水解程度不是很大,水解产物离不开平衡体系的情况[如Al2(SO4)3、NaAlO2、Na2CO3]来说,溶液蒸干后仍得原溶质。
(3)极端化认为水解相互促进即能水解彻底。如CH3COONH4溶液中尽管CH3COO-、NH水解相互促进,但仍然能大量共存,常见水解促进比较彻底而不能大量共存的离子有Al3+与AlO、CO(或HCO)、S2-(或HS-)、SO(或HSO)等。

 例1
例1 下列叙述正确的是( )
下列叙述正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4
B.25 ℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度增大
C.浓度均为0.1 mol.L-1的下列溶液,pH由大到小的排列顺序为NaOH>Na2CO3>(NH4)2SO4>NaHSO4
D.为确定二元酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
[解题思路] 分析选项涉及的平衡类型,加水稀释,先假设平衡不移动,确定离子浓度(特别是H+或OH-)变化情况,再考虑平衡移动,最终判断离子浓度的变化结果,相同离子,转化为改变某一组分的浓度,先确定移动的方向,再判断移动的结果,上述两种情况均不影响平衡常数;加热会使电离平衡、水解平衡向右移动。
解析 A项,醋酸稀释3<pH<4;B项,增大Cl-浓度,AgCl的溶解平衡左移,溶解度变小;C项,依据水解的微弱思想可判断同浓度的溶液,碱性NaOH>Na2CO3,酸性NaHSO4>(NH4)2SO4,得出C项正确的结论;D项,若H2A是弱酸,NaHA中可能存在两种趋势,HA-H++A-和HA-+H2OH2A+OH-,若HA-电离程度大于水解程度,则溶液pH<7,故D项错误。
答案 C
 例2
例2 (2016.全国卷Ⅲ,13)下列有关电解质溶液的说法正确的是( )
(2016.全国卷Ⅲ,13)下列有关电解质溶液的说法正确的是( )
A.向0.1 mol.L-1 CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
[解题思路] 将微粒浓度的比值转为常量(Ka、Kb、Kh、Kw)或单一变量,再根据条件判断对单一变量的影响,逐项分析,得出结论。
解析 A项,=,加水稀释,c(CH3COO-)减小,Ka不变,所以比值增大,错误;B项,=(Kh为水解常数),温度升高水解常数Kh增大,比值减小,错误;C项,向盐酸中加入氨水至中性,根据电荷守恒:c(NH)+c(H+)=c(Cl-)+c(OH-),此时c(H+)=c(OH-),故c(NH)=c(Cl-),所以=1,错误;D项,在饱和溶液中=,温度不变溶度积Ksp不变,则溶液中不变,正确。
答案 D

1.人体血液里存在重要的酸碱平衡:
CO2+H2OH2CO3(((,\s\up7(OH-H+HCO,使人体血液pH保持在7.35-7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO)∶c(H2CO3)变化关系如下表:
|
c(HCO)∶c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
|
pH |
6.10 |
7.35 |
7.40 |
7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO)
D.pH=7.40的血液中,HCO的水解程度一定大于H2CO3的电离程度
答案 D
解析 A项,人体血液pH小于7.35时碳酸会转化成碳酸氢根,使酸性降低,当人体血液pH大于7.45时,碳酸氢根会转化成碳酸增大酸度,所以正常人体血液中,HCO的水解程度大于电离程度,正确;B项,人体血液酸中毒时,只要增加碳酸氢根即可缓解,所以可注射NaHCO3溶液缓解酸中毒,正确;C项,从pH随c(HCO)∶c(H2CO3)变化关系表知,pH=7.00的血液中,c(H2CO3)<c(HCO),正确;D项,pH=7.40的血液中,c(HCO)∶c(H2CO3)=20.0,只能说明血液中的HCO远大于H2CO3但并不能说明HCO的水解程度一定大于H2CO3的电离程度,错误。
2.室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
|
选项 |
加入的物质 |
结论 |
|
A |
50 mL 1 mol.L-1 H2SO4 |
反应结束后,c(Na+)=c(SO) |
|
B |
0.05 mol CaO |
溶液中增大 |
|
C |
50 mL H2O |
由水电离出的c(H+).c(OH-)不变 |
|
D |
0.1 mol NaHSO4固体 |
反应完全后,溶液pH减小,c(Na+)不变 |
答案 B
解析 A项,Na+的物质的量为0.1 mol,而SO的物质的量为0.05 mol,混合溶液中Na+与SO的浓度不可能相等;B项,加入0.05 mol CaO后,会生成Ca(OH)2,Ca(OH)2与Na2CO3反应生成CaCO3沉淀和NaOH,溶液中c(OH-)增大,CO水解产生的HCO减少,故溶液中增大;C项,加入水后,c(Na2CO3)减小,CO水解产生的c(OH-)减小,溶液中的OH-来源于水的电离,因水电离产生的c(OH-)=c(H+),故由水电离出的c(H+).c(OH-)减小;D项,加入0.1 mol NaHSO4固体,溶液体积变化不大,但n(Na+)变为原来的2倍,故c(Na+)增大。
3.(2016.海南,5)向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
A.c(CO) B.c(Mg2+)
C.c(H+) D.Ksp(MgCO3)
答案 A
解析 MgCO3固体的溶液中存在溶解平衡:MgCO3(s)Mg2+(aq)+CO(aq),加入少量浓盐酸可与CO反应促使溶解平衡正向移动,故溶液中c(Mg2+)及c(H+)增大,c(CO)减小,Ksp(MgCO3)只与温度有关,不变。
4.下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25 ℃时,0.1 mol.L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)
答案 C
解析 CH3COOHCH3COO-+H+,加入醋酸钠相当于增大CH3COO-的浓度,使电离平衡逆向移动,减小醋酸的电离程度,A错误;HNO3+NH3.H2O===NH4NO3+H2O,二者等体积等浓度混合后反应生成NH4NO3,溶液呈酸性,25 ℃时溶液pH<7,B错误;溶液的导电能力与离子的浓度及离子所带的电荷数有关,H2SH++HS-,Na2S===2Na++S2-,H2S为弱电解质,Na2S为强电解质,等浓度时H2S溶液导电能力较弱,C正确;Ksp(AgCl)=c(Ag+).c(Cl-),Ksp(AgI)=c(Ag+).c(I-),Ksp(AgCl)与Ksp(AgI)不相等,溶液中c(Ag+)相等,所以c(Cl-)与c(I-)不相等,D错误。
[新题预测]
5.(2017.赣州模拟)下表是3种物质在水中的溶解度(20 ℃),下列说法中正确的是( )
|
物质 |
MgCl2 |
Mg(OH)2 |
MgCO3 |
|
溶解度/g |
54.6 |
0.000 84 |
0.039 |
A.已知MgCO3的Ksp=2.14×10-5,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO),且c(Mg2+).c(CO)=2.14×10-5
B.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
C.将适量的表中的三种物质分别与足量水混合,充分加热、灼烧,最终的固体产物相同
D.用石灰水处理水中的Mg2+和HCO,发生的离子反应方程式为Mg2++2HCO+Ca2++2OH-===CaCO3↓+MgCO3↓+2H2O
答案 C
解析 含有固体MgCO3的溶液是饱和溶液,只要温度不变,c(Mg2+).c(CO)就不变,等于2.14×10-5,但是溶液中若含有其他的Mg2+或CO,如含氯化镁,则Mg2+和CO的浓度不相等 ,A项错误;由于MgCO3的溶解度大于Mg(OH)2,最佳试剂应为NaOH,B项错误;MgCl2溶液加热水解,生成Mg(OH)2,Mg(OH)2更难溶,加热MgCO3悬浊液时,会转化为Mg(OH)2,灼烧Mg(OH)2最终产物均为MgO,C项正确;D项应生成Mg(OH)2沉淀。
6.苯甲酸钠(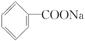 ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中加入苯甲酸钠时,会发生如下离子反应:A-+H2CO3===HA+HCO
答案 C
解析 苯甲酸钠(NaA)在溶液中发生水解:A-+H2OHA+OH-,饮料中充入CO2,消耗OH-,平衡向右移动,c(HA)增大,抑菌能力提高,A错误;提高CO2充气压力,溶液中c(H+)增大,饮料中c(HA)增大,c(A-)减小,B错误;pH=5.0时,溶液中c(H+)=1.0×10-5 mol.L-1,则===0.16,C正确;由苯甲酸的Ka大于H2CO3的Ka1可知,H2CO3不能制取 ,D项错误。
,D项错误。
7.已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO+H2OH2SO3+OH- ①
HSOH++SO ②
向0.1 mol.L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO)增大
B.加入适量Na2SO3固体,至溶液呈中性时,=1
C.加入少量NaOH溶液,、的值均增大
D.加入少量NaHSO3固体,①、②两平衡向右移动,HSO的电离程度和水解程度均增大
答案 C
解析 根据加入物质的性质判断平衡移动方向,进一步判断各选项结论是否正确。
A项,加入金属钠后,钠和水反应生成氢氧化钠,使平衡①左移,平衡②右移,移动的结果是c(SO)增大。可以利用极端分析法判断,如果金属钠适量,充分反应后溶液中溶质可以是亚硫酸钠,此时c(HSO)很小,所以A项错误;B项,依据电荷守恒判断,溶液呈中性时,即c(Na+)=c(HSO)+2c(SO),>1,所以B项错误;C项,加入氢氧化钠溶液后,溶液酸性减弱,碱性增强,所以增大;平衡①左移,平衡②右移,最终c(SO)增大,c(HSO)减小,所以增大;D项,加入NaHSO3时,HSO的浓度增大,其电离程度和水解程度均减小。
角度二 溶液中离子浓度关系判断

1.理解溶液中的“三个守恒”关系
(1)电荷守恒:电解质溶液中阴离子所带电荷总数等于阳离子所带电荷总数,根据电荷守恒可准确、快速地解决电解质溶液中许多复杂的离子浓度问题。
(2)物料守恒:物质发生变化前后,有关元素的存在形式不同,但元素的种类和原子数目在变化前后保持不变,根据物料守恒可准确、快速地解决电解质溶液中复杂离子、分子、物质的量浓度或物质的量的关系。
(3)质子守恒:在电离或水解过程中,会发生质子(H+)转移,但质子转移过程中其数量保持不变。
将混合溶液中的电荷守恒式和物料守恒式相联立,通过代数运算消去其中未参与平衡移动的离子,即可推出溶液中的质子守恒式。
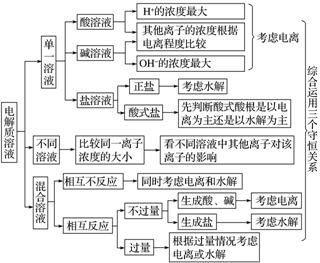
2.三个守恒的综合应用
应用三种守恒关系解决电解质溶液中离子浓度关系时,要清楚电解质溶液中微粒存在的变化(水解或电离),抓住守恒的实质,将由守恒所得的关系结合起来使用。综合运用三种守恒关系,理清一条思路,掌握分析方法。如图所示:

 例1
例1 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验编号 |
起始浓度/mol.L-1 |
反应后溶液的pH |
|
|
c(HA) |
c(KOH) |
||
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol.L-1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol.L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
[解题思路] 混合溶液的离子浓度关系首先判断反应后是否有物质剩余,确定溶液的组成。解答该题的关键是用好“三个守恒”。
解析 KA为强碱弱酸盐,溶液呈碱性,A-会发生水解,则A项正确;根据溶液中的电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),则c(OH-)=c(K+)+c(H+)-c(A-),故B项错误;要使等体积的HA弱酸溶液和KOH强碱溶液混合后呈中性,则酸的浓度应大于碱的,由物料守恒得C项正确;D项,中性溶液下水的电离较微弱,所以有c(K+)=c(A-)>c(OH-)=c(H+)。
答案 B
 例2
例2 下列电解质溶液中微粒的物质的量浓度关系一定正确的是( )
下列电解质溶液中微粒的物质的量浓度关系一定正确的是( )
A.在0.1 mol.L-1 NaHCO3溶液中:c(Na+)>c(HCO)>c(CO)>c(H2CO3)
B.在0.1 mol.L-1 NaClO溶液中:c(OH-)=c(H+)+c(HClO)
C.某温度下,CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.已知酸性:HCOOH>CH3COOH,相同浓度的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-)
解析 碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,所以水解出的碳酸分子浓度大于电离出的碳酸根离子浓度,A项错误;根据质子守恒,B项正确;没有说明溶液的温度是否为常温,则pH=7不一定是中性,所以氢离子浓度和氢氧根离子浓度不一定相等,C项错误;已知酸性:HCOOH>CH3COOH,所以甲酸根离子水解程度小于乙酸根离子水解程度,所以在等浓度的甲酸钾和乙酸钠溶液中钾离子和钠离子浓度相等,甲酸根离子浓度大于乙酸根离子浓度,所以c(K+)-c(HCOO-)<c(Na+)-c(CH3COO-),D项错误。
答案 B
1.25 ℃时,在10 mL浓度均为0.1 mol.L-1的NaOH和NH3.H2O混合溶液中滴加0.1 mol.L-1盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)=c(NH3.H2O)
B.加入10 mL盐酸时:c(NH)+c(H+)=c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
D.加入20 mL盐酸时:c(Cl-)=c(NH)+c(Na+)
答案 B
解析 未加盐酸时,氢氧化钠完全电离,Na+浓度为0.1 mol.L-1,一水合氨会部分电离,一水合氨的浓度小于0.1 mol.L-1,c(Na+)>c(NH3.H2O),A错误;加入10 mL盐酸时,Na+浓度等于Cl-浓度,根据电荷守恒可得B正确;加入盐酸至溶液pH=7时,根据电荷守恒,Cl-浓度等于Na+浓度与NH浓度之和,C错误;加入20 mL盐酸时,恰好完全反应,生成以氯化钠和氯化铵为溶质的混合溶液,溶液显酸性,根据电荷守恒,NH与Na+浓度之和小于Cl-浓度,D错误。
2.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol.L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
答案 D
解析 pH=5的H2S溶液中,存在H2SHS-+H+,HS-S2-+H+,所以c(H+)>c(HS-),A项错误;因为NH3.H2O为弱碱,稀释10倍,pH改变小于1个单位,所以a<b+1,B项错误;当草酸与氢氧化钠溶液混合后,溶液中还存在C2O,C项错误;根据CH3COOH、HClO、H2CO3的酸性相对强弱可以确定三种溶液的浓度大小,D项正确。
3.室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
答案 B
解析 在Na2S溶液中存在:H2OOH-+H+以及S2-+H2OHS-+OH-、HS-+H2OH2S+OH-,溶液中粒子浓度关系为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)>c(H+),A错误;利用质子守恒知,Na2C2O4溶液中存在:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4),B正确;利用电荷守恒知,Na2CO3溶液中:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),C错误;利用物料守恒可知,CH3COONa和CaCl2的混合液中c(Na+)+c(Ca2+)=c(CH3COOH)+c(CH3COO-)+c(Cl-),D错误。
4.下列叙述正确的是( )
A.0.1 mol.L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
答案 D
解析 乙酸钠是强碱弱酸盐,溶液为碱性,A错误;温度不变,Kw不变,B错误;pH相等,则溶液中c(H+)相等,C错误;硫化银溶解度小于AgCl,当加入AgCl固体时,AgCl沉淀会转化为Ag2S,c(S2-)下降,D正确。
[新题预测]
5.常温时,在(NH4)2SO4溶液中滴加Ba(OH)2溶液,下列有关选项正确的是( )
A.滴加前:c(NH)+c(H+)=c(OH-)+c(SO)
B.滴加前:c(NH)+c(NH3.H2O)=c(SO)
C.滴加至完全沉淀:c(OH-)>c(NH)>c(H+)
D.滴加至中性:c(SO)=2c(NH)>c(H+)=c(OH-)
答案 C
解析 根据电荷守恒,应有c(NH)+c(H+)=c(OH-)+2c(SO),故A错误;根据物料守恒,应是c(NH)+c(NH3.H2O)=2c(SO),故B错误;滴加至完全沉淀,发生的离子反应:2NH+SO+Ba2++2OH-===BaSO4↓+2NH3.H2O,溶液显碱性,一水合氨属于弱碱,因此离子浓度是c(OH-)>c(NH)>c(H+),故C正确;根据电荷守恒,c(NH)+c(H+)+2c(Ba2+)=c(OH-)+2c(SO),且c(H+)=c(OH-),因此有:c(NH)+2c(Ba2+)=2c(SO)>c(H+)=c(OH-),故D错误。
6.(2017.成都外国语学校月考)下列说法正确的是( )
A.0.01 mol.L-1的Na2HPO4溶液中存在如下的平衡:HPOH++PO,加水稀释,使溶液中的HPO、H+、PO的浓度均减小
B.饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH)+c(OH-)+2c(NH3.H2O)
C.常温下,0.01 mol.L-1的HA和BOH两种溶液,其pH分别为3和12,将两溶液等体积混合后,所得溶液的pH≤7
D.在NH4HSO3与NH4Cl混合溶液中,c(NH)=c(SO)+c(HSO)+c(H2SO3)+c(Cl-)
答案 B
解析 0.01 mol.L-1的Na2HPO4溶液中HPO的水解程度大于电离程度,故溶液显碱性:HPO+H2OOH-+H2PO,加水稀释,溶液中的Na+、HPO、OH-、PO浓度均减小,但H+浓度增大,A错误;饱和NH4Cl溶液中存在电荷守恒c(H+)+c(NH)=c(Cl-)+c(OH-),另外还存在物料守恒c(NH3.H2O)+c(NH)=c(Cl-),则溶液中c(H+)+c(Cl-)=c(NH)+c(OH-)+2c(NH3.H2O),B正确;常温下,0.01 mol.L-1的HA和BOH两种溶液pH分别为3和12,说明HA是弱酸,BOH是强碱,将两溶液等体积混合后生成BA和水,其中A-水解使溶液显碱性,所得溶液的pH>7,C错误;在NH4HSO3中,n(N)∶n(S)=1∶1,在NH4Cl中,n(N)∶n(Cl)=1∶1,故在混合溶液中n(N)=n(S)+n(Cl),故c(NH)+c(NH3.H2O)=c(SO)+c(HSO)+c(H2SO3)+c(Cl-),D错误。
7.10 mL浓度均为0.1 mol.L-1的三种溶液:①HF溶液;②KOH溶液;③KF溶液。下列说法正确的是( )
A.①和②混合后,酸碱恰好中和,溶液呈中性
B.①和③混合:c(F-)+c(OH-)=c(H+)+c(HF)
C.①、③中均有c(F-)+c(HF)=0.1 mol.L-1
D.由水电离出的c(OH-):②>③>①
答案 C
解析 ①和②中n(HF)=n(KOH),HF和KOH恰好中和,溶液呈碱性,A项错误;①和③混合后,由电荷守恒得c(F-)+c(OH-)=c(H+)+c(K+),由物料守恒得c(K+)=[c(HF)+c(F-)],两式联立,消去c(K+),得c(F-)+2c(OH-)=2c(H+)+c(HF),B项错误;HF电离出的H+、KOH电离出的OH-对水的电离均有抑制作用,因HF是弱酸,KOH是强碱,浓度相同时,②中的OH-浓度比①中的H+浓度大,②对水的电离抑制作用更大;KF中F-的水解对水的电离有促进作用,因此由水电离出的c(OH-):③>①>②,D项错误。
角度三 结合图像判断溶液中粒子浓度的变化

结合图像分析电离平衡、水解平衡、溶解平衡,判断离子浓度的关系是全国卷考查的重点,常考图像类型总结如下:
1.一强一弱溶液的稀释图像
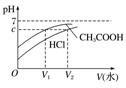
(1)相同体积、相同浓度的盐酸、醋酸
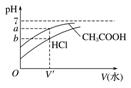 |
 |
|
加水稀释相同的倍数,醋酸的pH大 |
加水稀释到相同的pH,盐酸加入的水多 |
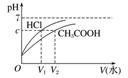
(2)相同体积、相同pH值的盐酸、醋酸
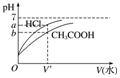 |
 |
|
加水稀释相同的倍数,盐酸的pH大 |
加水稀释到相同的pH,醋酸加入的水多 |
(3)pH与稀释倍数的线性关系
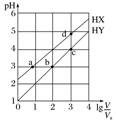 |
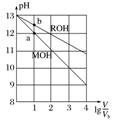 |
|
(1)HY为强酸、HX为弱酸 (2)a、b两点的溶液中:c(X-)=c(Y-) (3)水的电离程度:d>c>a=b |
(1)MOH为强碱、ROH为弱碱 (2)c(ROH)>c(MOH) (3)水的电离程度:a>b |
2.Kw和Ksp曲线
(1)双曲线型
|
不同温度下水溶液中c(H+)与c(OH-)的变化曲线 |
常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6] |
 |
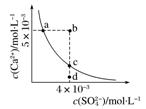 |
|
(1)A、C、B三点均为中性,温度依次升高,Kw依次增大 (2)D点为酸性溶液,E点为碱性溶液,Kw=1×10-14 (3)AB直线的左上方均为碱性溶液,任意一点:c(H+)<c(OH-) |
(1)a、c点在曲线上,a→c的变化为增大c(SO),如加入Na2SO4固体,但Ksp不变 (2)b点在曲线的上方,Qc>Ksp,将会有沉淀生成 (3)d点在曲线的下方,Qc<Ksp,则为不饱和溶液,还能继续溶解CaSO4 |
(2)直线型(pM-pR曲线)
pM为阳离子浓度的负对数,pR为阴离子浓度的负对数
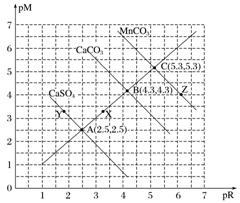
①直线AB上的点:c(M2+)=c(R2-);
②溶度积:CaSO4>CaCO3>MnCO3;
③X点对CaSO4要析出沉淀,对CaCO3是不饱和溶液,能继续溶解CaCO3;
④Y点:c(SO)>c(Ca2+),二者的浓度积等10-5;Z点:c(CO)<c(Mn2+),二者的浓度积等10-10.6。
3.酸碱中和滴定
|
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线 |
盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线 |
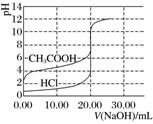 |
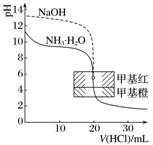 |
|
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高 |
|
|
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应) |
|
|
室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸(强酸与弱碱)反应时,终点不是pH=7(强碱与弱酸反应终点是pH>7,强酸与弱碱反应终点是pH<7) |
4.分布系数图及分析[分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线]
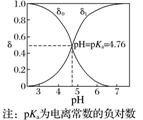
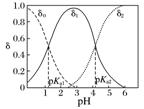
|
一元弱酸(以CH3COOH为例) |
二元酸(以草酸H2C2O4为例) |
 |
 |
|
δ0为CH3COOH分布系数,δ1为CH3COO-分布系数 |
δ0为H2C2O4分布系数、δ1为HC2O分布系数、δ2为C2O分布系数 |
|
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据分布系数可以书写一定pH时所发生反应的离子方程式 |
|
|
同一pH条件下可以存在多种溶质微粒。根据在一定pH的微粒分布系数和酸的分析浓度,就可以计算各成分在该pH时的平衡浓度 |

 例1
例1 已知MOH和ROH均为一元碱,常温下对其水溶液分别加水稀释时,pH变化如图所示。下列说法正确的是( )
已知MOH和ROH均为一元碱,常温下对其水溶液分别加水稀释时,pH变化如图所示。下列说法正确的是( )
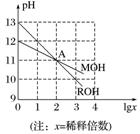
A.在A点时,由H2O电离出的c(H+)相等,c(M+)=c(R+)
B.稀释前,ROH溶液的物质的量浓度等于MOH溶液的物质的量浓度的10倍
C.稀释前的ROH溶液与等体积pH=1的H2SO4溶液混合后所得溶液显酸性
D.等体积、等浓度的MOH溶液和HCl溶液混合后,溶液中离子浓度大小关系为c(Cl-)>c(M+)>c(OH-)>c(H+)
[思路点拨] 本题为电离平衡图像题,需要学生结合选项要求,从图像中提取有用信息进行解答。
|
审题 |
信息提取 |
题目解答 |
|
分析题干信息及四个选项,粗略分析图像信息 |
由图像中两条线段的变化规律,推断出两种碱的强弱(这是解答该题的关键信息) |
确定两条线段的交点(A点)的含义,结合分析出的两种碱的强弱,根据选项内容,确定合理选项 |
解析 由图可知,稀释前ROH溶液的pH=13,稀释100倍时pH=11,故ROH为强碱,而稀释前MOH的pH=12,稀释100倍时pH=11,故MOH为弱碱。由ROH===R++OH-、MOHM++OH-可知,在A点,两种溶液的c(OH-)相等,则c(M+)=c(R+),A项正确;稀释前,ROH溶液的物质的量浓度为0.1 mol.L-1,MOH溶液的物质的量浓度大于0.01 mol.L-1,则ROH溶液的物质的量浓度小于MOH溶液的物质的量浓度的10倍,B项错误;稀释前的ROH溶液与等体积pH=1的H2SO4溶液混合后恰好中和生成盐,溶液显中性,C项错误;MOH为弱碱,等体积、等浓度的MOH溶液与盐酸混合,反应生成强酸弱碱盐,水解显酸性,故c(H+)>c(OH-),D项错误。
答案 A
 例2
例2 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1 mol.L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1 mol.L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
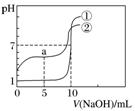
A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化
B.酸溶液的体积均为10 mL
C.a点:c(CH3COOH)>c(CH3COO-)
D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)
[解题思路] 比较图像起点→①代表盐酸且浓度为0.1 mol.L-1→pH=7的点(盐酸与10 mL NaOH完全中和)→盐酸为10 mL,a点醋酸被中和一半,CH3COOH和CH3COONa等物质的量混合,可据此判断。
解析 A项,①代表盐酸,②代表醋酸,正确;B项,向盐酸中加入10 mL NaOH时,pH=7,所以盐酸体积为10 mL,正确;C项,a点是CH3COOH和CH3COONa等物质的量混合,溶液呈酸性,电离大于水解,c(CH3COOH)<c(CH3COO-),错误;D项,符合电荷守恒,正确。
答案 C
 例3
例3 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是( )
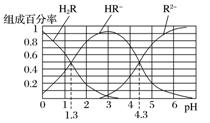
A.在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B.等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
C.在pH=3的溶液中存在=10-3
D.向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO+H2R===2HCO+R2-
[解题思路] 本题考查弱电解质在水溶液中的电离平衡,图像的交点pH→H2R的Ka1、Ka2→判断H2CO3与H2R的强弱;曲线的最高点→HR-、R2-、H2R含量及pH→HR-的电离程度大于水解程度。
解析 A项,在pH=4.3的溶液中,c(HR-)=c(R2-),根据溶液中电荷守恒2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),可知3c(R2-)=c(Na+)+c(H+)-c(OH-),正确;B项,等体积等浓度的NaOH溶液与H2R溶液混合生成NaHR,此时HR-含量最高,H2R和R2-含量接近于0,由题图可知,此时pH接近于3,溶液显酸性,对水的电离起到抑制作用,所以溶液中水的电离程度比纯水小,错误;C项,当溶液pH=1.3时,c(H2R)=c(HR-),则Ka1==10-1.3,当溶液pH=4.3时,c(R2-)=c(HR-),则Ka2==10-4.3,===10-3,正确;D项,由C选项分析可知,H2R的电离常数Ka2大于H2CO3的Ka2,即酸性:HR->HCO,所以向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO+H2R===2HCO+R2-,正确。
答案 B

1.(2016.全国卷Ⅰ,12)298 K时,在20.0 mL 0.10 mol.L-1氨水中滴入0.10 mol.L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol.L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
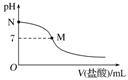
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
答案 D
解析 A项,盐酸滴定氨水时,滴定终点溶液为NH4Cl溶液,呈酸性,故指示剂应选甲基橙,错误;B项,一水合氨属于弱碱,与盐酸正好反应生成NH4Cl时溶液呈酸性,故二者等浓度反应时,若溶液的pH=7,盐酸的体积应小于氨水的体积,即小于20.0 mL,错误;C项,根据电荷守恒可知溶液中:c(NH)+c(H+)=c(Cl-)+c(OH-),M点溶液的pH=7,即c(H+)=c(OH-),则c(NH)=c(Cl-),故c(NH)=c(Cl-)>c(H+)=c(OH-),错误;D项,由图可知,N点即为0.10 mol.L-1氨水,由其电离度为1.32%,可知0.10 mol.L-1氨水中c(OH-)=0.001 32 mol.L-1,故该氨水中11<pH<12,正确。
2.T ℃下的溶液中,c(H+)=10-x mol.L-1,c(OH-)=10-y mol.L-1,x与y的关系如图所示。下列说法不正确的是( )
A.T ℃时,水的离子积Kw为1×10-13
B.T>25
C.T ℃时,pH=7的溶液显碱性
D.T ℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7
答案 D
解析 从图中不难看出,A正确;T ℃时Kw>1×10-14,则T ℃一定高于常温,B正确;T ℃时,pH=6.5的溶液呈中性,显然pH=7的溶液显碱性,C正确;pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,二者恰好完全中和,但注意该温度下,pH=7的溶液不是中性溶液,D错误。
3.在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
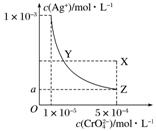
A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
答案 C
解析 物质的Ksp只与温度有关,A项正确;X点的Ksp大于Y点的Ksp,因此由Y点变为X点只能通过改变温度实现,B项正确;T ℃时,Ag2CrO4的Ksp=c(CrO).c2(Ag+)=(1×10-3)2×10-5=1×10-11,C项错误;温度不变,Ksp不变,Ksp=1×10-11=a2×5×10-4,解得a=×10-4,D项正确。
4.(2015.全国卷Ⅰ,13)浓度均为0.10 mol.L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示。下列叙述错误的是( )
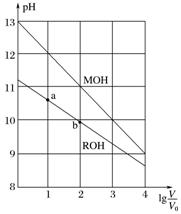
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则增大
答案 D
解析 A项考查根据图像判断电解质的碱性强弱。“起点”隐藏的信息是0.10 mol.L-1的MOH溶液和ROH溶液的pH分别为13和小于13,说明MOH是强电解质即强碱,ROH是弱电解质即弱碱,不符合题意;B项考查弱电解质电离程度的大小比较。稀释过程中隐藏的信息:弱碱的浓度越小电离程度越大,即稀释程度越大电离程度越大;由图中b点的稀释程度大于a点的稀释程度知,b点的电离程度大于a点的,不符合题意;C项考查电解质溶液稀释过程中离子浓度的变化。隐藏的信息:溶液无限稀释后,溶液应接近中性,即c(OH-)相等,不符合题意;D项考查外界因素对电离平衡的影响。升温促进弱电解质电离,而对强电解质电离无影响(因为已经全部电离),即c(M+)不变,c(R+)增大,则减小,符合题意。
5.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
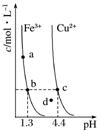
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
答案 B
解析 Ksp[Fe(OH)3]=c(Fe3+).c3(OH-),Ksp[Cu(OH)2]=c(Cu2+).c2(OH-),Fe3+、Cu2+浓度相等(b、c点)时,Fe3+对应的pH小,c(H+)较大,则c(OH-)较小,在相同温度下,Ksp[Fe(OH)3]<Ksp[Cu(OH)2],A选项正确;存在沉淀溶解平衡:Fe(OH)3(s)Fe3+(aq)+3OH-(aq),加入NH4Cl固体,因为NH水解产生H+,H+与OH-反应使平衡正向移动,c(Fe3+)增大,B选项错误;c(H+)和c(OH-)的乘积为Kw,Kw仅与温度有关,则C选项正确;由题意和图知D选项正确。
[新题预测]
6.常温下,向10 mL 0.1 mol.L-1的HR溶液中逐滴滴入0.1 mol.L-1的NH3.H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是( )
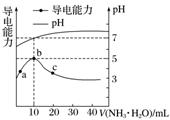
A.a-b点导电能力增强,说明HR为弱酸
B.b点溶液pH=5,此时酸碱恰好中和
C.c点溶液存在c(NH)>c(R-)、c(OH-)>c(H+)
D.b-c任意点溶液均有c(H+).c(OH-)=Kw=1.0×10-14
答案 B
解析 A项,根据图像可知,a-b点导电能力增强,说明HR为弱电解质,在溶液中部分电离,加入氨水后生成强电解质,离子浓度增大;B项,b点溶液pH=7,此时加入10 mL HR,HR与一水合氨的浓度、体积相等,则二者恰好反应;C项,c点时溶液的pH>7,混合液显示碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH)>c(R-);D项,b-c点,溶液的温度不变,则水的离子积不变。
7.下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )
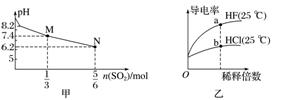

A.若甲表示用1 L 1 mol.L-1 Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO)>c(HSO)
B.由图乙可知,a点Kw的数值比b点Kw的数值大
C.图丙表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D.图丁表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
答案 C
解析 A项,M点pH=7.4,n(SO2)= mol,Na2SO3+SO2+H2O===2NaHSO3,溶液则得到 mol NaHSO3,剩余 mol Na2SO3,亚硫酸根离子水解显碱性,亚硫酸氢根离子电离显酸性,而溶液显碱性,说明亚硫酸根离子水解程度大,则c(SO)<c(HSO);B项,由于a、b两点的温度相同,所以Kw的数值相同;C项,稀释相同的倍数,ROH的pH变化较大,因而碱性强,故C正确;D项,加入Na2SO4增加硫酸根的浓度,BaSO4的溶解平衡向左移动,Ba2+浓度减小,仍在曲线上,且在a点的右下方。
8.已知草酸为二元弱酸:
H2C2O4HC2O+H+ Ka1
HC2OC2O+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4)
B.pH=2.7的溶液中:=1 000
C.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
答案 C
解析 pH=1.2时,H2C2O4、HC2O的物质的量分数相等,且c(K+)+c(H+)=c(OH-)+c(HC2O),则c(K+)+c(H+)=c(OH-)+c(H2C2O4),故A项正确;由图像可知pH=1.2时,c(HC2O)=c(H2C2O4),则Ka1==c(H+)=10-1.2,pH=4.2时,c(HC2O)=c(C2O),Ka2==c(H+)=10-4.2,由电离常数可知==1 000,故B项正确;将相同物质的量的KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故C项错误;向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离的抑制程度减小,水的电离度一定增大,故D项正确。
高考12题逐题特训
A组
1.下列选项中的数值前者小于后者的是( )
A.25 ℃和100 ℃时H2O的Kw
B.同温同浓度的KHCO3溶液和NH4HCO3溶液中的c(HCO)
C.同温同浓度的NaHCO3溶液和CH3COONa溶液的pH
D.中和25 mL 0.1 mol.L-1 NaOH溶液所需CH3COOH和HCl的物质的量
答案 A
解析 NH4HCO3中NH与HCO相互促进水解,使c(HCO)浓度比KHCO3中的小,B项错误;由酸性CH3COOH大于H2CO3知,HCO的水解程度比CH3COO-的水解程度大,溶液的pH前者大于后者,C项错误;中和25 mL 0.1 mol.L-1 NaOH溶液所需CH3COOH和HCl物质的量相等,D项错误。
2.一定条件下,下列说法正确的是( )
A.向氨水中加入氯化铵固体,会使溶液的pH减小
B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大
C.常温时,把pH=1的醋酸溶液稀释到10倍后,其pH大于2
D.稀释Na2CO3溶液,溶液中c(OH-)增大
答案 A
解析 氨水中存在电离平衡:NH3.H2ONH+OH-,加入NH4Cl固体,溶液中c(NH)增大,平衡逆向移动,c(OH-)减小,溶液的pH减小,A正确;温度不变,则Ksp(CaCO3)不变,B错误;醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加水稀释时,电离平衡正向移动,n(H+)增大,故pH=1的醋酸溶液稀释10倍后,溶液的pH范围为1<pH<2,C错误;Na2CO3溶液中存在水解平衡:CO+H2OHCO+OH-,加水稀释时,水解平衡正向移动,n(OH-)增大,但由于溶液体积变化大于n(OH-)的变化,则溶液中c(OH-)减小,D错误。
3.饱和氨水中存在化学平衡:NH3+H2ONH3.H2ONH+OH-。下列有关说法正确的是( )
A.常温下饱和氨水的pH<7
B.向氨水中滴加过量硫酸,所有平衡均正向移动,pH增大
C.电离是吸热过程,升高温度,所有平衡均正向移动
D.向氨水中加入少量NaOH固体,所有平衡均逆向移动,有NH3放出
答案 D
解析 氨水呈碱性,常温下pH>7,A错误;向氨水中滴加过量硫酸,所有平衡正向移动,但溶液pH减小,B错误;电离过程吸热,升高温度平衡向电离的方向移动,但对于平衡NH3+H2ONH3.H2ONH+OH-,升高温度,NH3.H2O会分解,平衡向左移动,C错误;向氨水中加入NaOH,c(OH-)增大,平衡逆向移动,有NH3逸出,故D正确。
4.已知室温时,0.1 mol.L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
C.在该温度下加水稀释,溶液中的减小
D.此酸的电离平衡常数约为1.0×10-7
答案 C
解析 电离出的氢离子浓度为0.1 mol.L-1×0.1%=0.000 1 mol.L-1,溶液的pH=4,A正确;水电离出的氢离子浓度等于溶液中的氢氧根离子浓度,即c(H+)水=c(OH-)= mol.L-1=10-10 mol.L-1,所以酸电离出的氢离子浓度与水电离出的氢离子浓度之比为=106,B正确;溶液中=,加水稀释,c(A-)减小,Ka不变,则比值增大,C错误;HAH++A-,Ka==≈1.0×10-7,D正确。
5.下表是Fe2+、Fe3+、Zn2+被OH-完全沉淀时溶液的pH。某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的ZnSO4,应加入的试剂是( )
|
金属离子 |
Fe2+ |
Fe3+ |
Zn2+ |
|
完全沉淀时的pH |
7.7 |
4.5 |
6.5 |
A.H2O2、ZnO B.氨水
C.KMnO4、ZnCO3 D.NaOH溶液
答案 A
解析 加氨水、KMnO4、NaOH都会引入杂质离子,故B、C、D项错误;Fe3+沉淀完全时溶液的pH=4.5,此时Zn2+未产生沉淀,故应向酸性溶液中加入H2O2,将Fe2+氧化成Fe3+,再加入ZnO调节溶液的pH至4.5,使Fe3+转化为Fe(OH)3沉淀,并过滤除去,蒸发结晶即可得到纯净的ZnSO4,A项正确。
6.已知298 K时下列物质的溶度积:
|
|
CH3COOAg |
AgCl |
Ag2CrO4 |
Ag2S |
|
Ksp |
2.3×10-3 |
1.77×10-10 |
1.12×10-12 |
6.7×10-15 |
下列说法正确的是( )
A.等体积、浓度均为0.02 mol.L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01 mol.L-1的CrO和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO先沉淀
C.在CH3COOAg悬浊液中加入盐酸,发生反应的离子方程式:CH3COOAg+H++Cl-===CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
答案 C
解析 浓度商Qc=c(CH3COO-).c(Ag+)=0.01×0.01=1×10-4,Ksp(CH3COOAg)=2.3×10-3,Qc<Ksp,所以溶液混合不能产生沉淀,故A项错误;AgCl饱和所需Ag+浓度c(Ag+)== mol.L-1=1.77×10-8 mol.L-1;Ag2CrO4饱和所需Ag+浓度c(Ag+)== mol.L-1≈1.1×10-5 mol.L-1,则1.77×10-8 mol.L-1<1.1×10-5 mol.L-1,所以Cl-先沉淀,故B项错误;CH3COOAg沉淀的溶度积大于AgCl沉淀的溶度积,所以离子方程式为CH3COOAg+H++Cl-===CH3COOH+AgCl,故C项正确;CH3COOAg饱和溶液中Ag+的浓度为 mol.L-1≈0.048 mol.L-1,c(CH3COOAg) ≈0.048 mol.L-1;AgCl饱和溶液中Ag+的浓度为≈1.33×10-5 mol.L-1,c(AgCl)=1.33×10-5 mol.L-1;设Ag2CrO4饱和溶液中Ag+的浓度为x mol.L-1,则CrO的浓度为0.5x mol.L-1,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=1.12×10-12,x3=2.24×10-12,即x=≈1.3×10-4,c(Ag2CrO4)=0.65×10-4 mol.L-1;设Ag2S饱和溶液中Ag+的浓度为x mol.L-1,则S2-的浓度为0.5x mol.L-1,由溶度积常数的表达式可知Ksp(Ag2S)=x2×0.5x=0.5x3=6.7×10-15,x3=13.4×10-15,即x≈2.38×10-5,c(Ag2S)=1.19×10-5 mol.L-1,则四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(Ag2CrO4)>c(AgCl)>c(Ag2S),故D项错误。
7.下列溶液一定呈中性的是( )
A.常温下,pH=10的氨水和pH=4的盐酸等体积混合
B.常温下,pH=11的MOH溶液和pH=3的HA溶液等体积混合
C.等物质的量浓度的强酸和强碱溶液等体积混合
D.c(NH)=c(F-)的NH4F和氨水的混合液
答案 D
解析 A项,由于NH3.H2O为弱碱,所以二者等体积混合后溶液中还有未反应完的NH3.H2O,从而使溶液呈碱性,错误;B项,若MOH为弱碱,HA是强酸,则二者等体积混合后溶液呈碱性;若HA为弱酸,MOH是强碱,则二者等体积混合后溶液呈酸性;若MOH是强碱,HA是强酸,则二者等体积混合后溶液呈中性,错误;C项,等物质的量浓度的硫酸和氢氧化钠、盐酸和氢氧化钡等体积混合后,溶液都不呈中性,错误;D项,根据电荷守恒可知c(H+)+c(NH)=c(OH-)+c(F-),因c(NH)=c(F-),故c(H+)=c(OH-),则混合液呈中性,正确。
8.下列物质用途或操作正确且与盐类水解有关的一组是( )
①用热饱和硫酸铵溶液清洗铁器表面的铁锈 ②明矾吸附水中杂质 ③用铁粉、氯化钠和炭粉的混合物作食品保鲜剂 ④在含氯化铁杂质的氯化铜溶液中加入过量的氧化铜,过滤除杂 ⑤在氯化氢气氛中灼烧氯化镁晶体制备无水氯化镁 ⑥用硫酸铜和石灰乳配制波尔多液杀虫剂 ⑦用泡沫灭火器灭火 ⑧配制Fe(NO3)2溶液时将Fe(NO3)2晶体溶于浓硝酸中并加蒸馏水稀释至指定浓度
A.①③④⑥⑦⑧ B.③④⑥⑦⑧
C.①②④⑤⑦ D.②③④⑤⑥⑦
答案 C
解析 ③和⑥用途正确,但与盐类水解无关;⑧操作错误,浓硝酸会氧化Fe2+,不能用此方法来配制Fe(NO3)2溶液。
9.常温下,下列有关电解质溶液叙述错误的是( )
A.某H2SO4溶液中=1.0×10-8,由水电离出的c(H+)=1×10-11 mol.L-1
B.将0.02 mol.L-1 HCl溶液与0.02 mol.L-1 Ba(OH)2溶液等体积混合后,溶液pH约为12
C.将一定体积稀盐酸与稀氨水混合,当溶质为NH3.H2O和NH4Cl时,溶液的pH≥7
D.向0.1 mol.L-1 Na2CO3溶液中逐滴滴加 0.1 mol.L-1稀盐酸,溶液中c(HCO)先增大后减小
答案 C
解析 常温下,水的离子积常数Kw=c(H+).c(OH-)=10-14,某H2SO4溶液中=1.0×10-8,则c(OH-)=1×10-11 mol.L-1,所以由水电离出的c(H+)=1×10-11 mol.L-1,A正确;将0.02 mol.L-1 HCl溶液与0.02 mol.L-1 Ba(OH)2溶液等体积混合后,c(OH-)==0.01 mol.L-1,所以溶液pH约为12,B正确;将一定体积稀盐酸与稀氨水混合,当溶质为NH3.H2O和NH4Cl时,因两者的量不确定,溶液的pH可能大于7,可能等于7,也可能小于7,C错误;向0.1 mol.L-1 Na2CO3溶液中逐滴滴加0.1 mol.L-1稀盐酸,首先发生反应:Na2CO3+HCl===NaHCO3+NaCl,然后发生反应:NaHCO3+HCl===NaCl+CO2↑+H2O,所以溶液中c(HCO)先增大后减小,D正确。
B组
1.下列说法中正确的是( )
A.纯水中滴入几滴稀硫酸,Kw和溶液pH均变小
B.保存FeSO4溶液时,加入少量稀硝酸抑制Fe2+水解
C.向CuSO4溶液中通入少量H2S,c(Cu2+)和溶液pH均减小
D.AlCl3溶液蒸干、灼烧至恒重,最终得到AlCl3固体
答案 C
解析 纯水中滴入几滴稀硫酸,H+浓度增大,pH变小,抑制水的电离,但温度不变,Kw不变,A项错误;保存FeSO4溶液时,可加入少量稀硫酸抑制Fe2+水解,但不能加稀硝酸,因为硝酸有氧化性,会将Fe2+氧化为Fe3+,B项错误;CuSO4与H2S发生复分解反应生成CuS沉淀和硫酸,所以c(Cu2+)减小,pH也减小,C项正确;AlCl3溶液在蒸干过程中会水解生成氢氧化铝,由于HCl挥发,最终水解完全,燃烧至恒重时氢氧化铝分解得到氧化铝,D项错误。
2.常温下,下列叙述不正确的是( )
A.c(H+)>c(OH-)的溶液一定显酸性
B.pH=3的弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性
C.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO)与c(H+)之比约为1∶10
D.中和10 mL 0.1 mol.L-1醋酸与100 mL 0.01 mol.L-1醋酸所需NaOH的物质的量不同
答案 D
解析 B项,pH=3的弱酸溶液与pH=11的强碱溶液等体积混合,弱酸浓度大,有剩余,反应后溶液显酸性,正确;C项,pH=5的硫酸溶液稀释到原来的500倍,则溶液接近于中性,c(H+)≈10-7 mol.L-1,c(SO)==10-8 mol.L-1,则c(SO)∶c(H+)≈1∶10,正确;D项,两份醋酸的物质的量相同,则所需NaOH的物质的量相同,错误。
3.足量的NaHSO3溶液和Na2CO3溶液混合后能产生CO2气体。下列说法正确的是( )
A.反应的离子方程式为2H++CO===H2O+CO2↑
B.若向Na2CO3溶液中通入足量SO2气体,也可得到CO2
C.HSO的水解程度大于其电离程度
D.Ka1(H2SO3)>Ka1(H2CO3)>Ka2(H2SO3)>Ka2(H2CO3)
答案 B
解析 亚硫酸是弱酸,故在离子方程式中“HSO”应作为一个整体来书写,A错误;由生成CO2知亚硫酸氢钠溶液呈酸性,HSO的电离程度大于其水解程度,C错误;因HSO能将CO转化为CO2,这说明亚硫酸的二级电离常数大于碳酸的一级电离常数,D错误。
4.Na2SO3溶液作为吸收液吸收SO2时,吸收液pH随n(SO)∶n(HSO)变化的关系如下表:
|
n(SO)∶n(HSO) |
91∶9 |
1∶1 |
9∶91 |
|
pH |
8.2 |
7.2 |
6.2 |
以下离子浓度关系的判断正确的是( )
A.NaHSO3溶液中,c(H+)<c(OH-)
B.Na2SO3溶液中,c(Na+)>c(SO)>c(HSO)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO)>c(HSO)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)>c(HSO)+c(SO)
答案 D
解析 用Na2SO3溶液吸收SO2时,随着吸收SO2的量增多,溶液由碱性逐渐变为酸性。由表中信息可知NaHSO3溶液为酸性溶液,A错误;Na2SO3溶液中SO存在二级水解,c(HSO)应小于c(OH-),B错误;由表中数据可知,当c(SO)=c(HSO)时,pH=7.2,故当吸收液呈中性时,可推出c(SO)<c(HSO),C错误。
5.常温下,下列溶液中的微粒浓度关系正确的是( )
A.向新制氯水中加入NaOH固体:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO)>c(CO)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+)
D.0.2 mol.L-1的CH3COOH溶液与0.1 mol.L-1的NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
答案 D
解析 A项,向新制氯水中加入NaOH固体,由电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),错误;B项,溶液pH=8.3,说明HCO的水解程度大于电离程度,水解产生的H2CO3浓度大于电离产生的CO浓度,错误;C项,常温下,pH之和等于14的两溶液,酸溶液中的c(H+)与碱溶液中的c(OH-)相等,等体积混合时,弱碱在反应过程中能继续电离,即碱过量,最终溶液显碱性,错误;D项,两者混合后发生反应,得到物质的量浓度相等的CH3COOH和CH3COONa混合溶液,物料守恒式为c(CH3COO-)+c(CH3COOH)=2c(Na+),电荷守恒式为c(H+)+c(Na+)=c(CH3COO-)+c(OH-),根据以上两式可得到2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),正确。
6.已知HCN的电离常数K=6.2×10-10。用物质的量都是0.1 mol的HCN和NaCN混合后配成1 L溶液,经测定溶液呈碱性。则下列关系式正确的是( )
A.c(CN-)>c(Na+)
B.c(CN-)>c(HCN)
C.c(HCN)+c(CN-)=0.2 mol.L-1
D.c(CN-)+c(OH-)=0.1 mol.L-1
答案 C
解析 HCN的电离常数为6.2×10-10,说明HCN为弱酸,物质的量都是0.1 mol的HCN和NaCN混合后配成1 L溶液,经测定溶液呈碱性,说明CN-的水解程度大于HCN的电离程度,c(OH-)>c(H+),则c(CN-)<c(HCN),根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(CN-),则c(Na+)>c(CN-),故A、B错误;根据物料守恒得:c(HCN)+c(CN-)=0.2 mol.L-1,故C正确;根据电荷守恒得:c(Na+)+c(H+)=c(CN-)+c(OH-),因此有c(CN-)+c(OH-)>0.1 mol.L-1,故D错误。
7.(2017.辽宁东北育才学校三模)25 ℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,下列判断不正确的是( )
|
实验编号 |
起始浓度/mol.L-1 |
反应后溶液的pH |
|
|
c(HA) |
c(NaOH) |
||
|
① |
0.10 |
0.10 |
9 |
|
② |
X |
0.05 |
7 |
A.X>0.05
B.将实验①所得溶液加水稀释后,变大
C.实验①所得溶液:c(A-)+c(HA)=0.10 mol.L-1
D.实验②所得溶液:c(Na+)+c(OH-)=c(A-)+c(H+)
答案 C
解析 等体积等浓度的HA和NaOH反应后,溶液显碱性,说明HA为弱酸,实验②反应后所得溶液显中性,则HA过量,即X>0.05,A项正确;将实验①所得溶液加水稀释后,溶液中A-的水解程度增大,则溶液中n(OH-)增大,n(A-)减小,故变大,B项正确;实验①中酸碱恰好完全中和,根据物料守恒可知反应后的溶液中c(Na+)=c(A-)+c(HA)=0.05 mol.L-1,C项错误;实验②所得溶液中,c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),可得c(Na+)+c(OH-)=c(A-)+c(H+),D项正确。
8.下列有关电解质溶液中,物质的量浓度关系错误的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.25 ℃时,pH=4.7浓度均为0.1 mol.L-1的CH3COOH、CH3COONa的混合溶液中:(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
C.氢硫酸的酸性比碳酸弱,则NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-)
D.①0.2 mol.L-1 NH4Cl溶液,②0.1 mol.L-1 (NH4)2Fe(SO4)2溶液,③0.2 mol.L-1 NH4HSO4溶液,④0.1 mol.L-1 (NH4)2CO3溶液中,c(NH)大小:③>②>①>④
答案 C
解析 氢硫酸的酸性比碳酸弱,则NaHS溶液中,HS-在溶液中以水解为主,显碱性,离子浓度应为c(Na+)>c(HS-)>c(OH-)>c(H+)。
9.还原沉淀法是处理含铬(含Cr2O和CrO)工业废水的常用方法,过程如下:CrOH+转换Cr2OFe2+还原Cr3+OH-沉淀Cr(OH)3↓,已知转化过程中反应为2CrO(aq)+2H+(aq)===Cr2O(aq)+H2O(l)。转化后所得溶液中铬元素含量为28.6 g.L-1,CrO有转化为Cr2O。下列说法不正确的是( )
A.若用绿矾(FeSO4.7H2O)(M=278)作还原剂,处理1 L废水,至少需要绿矾917.4 g
B.溶液颜色保持不变,说明上述可逆反应达到平衡状态
C.常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5 mol.L-1,应调溶液的pH=5
答案 A
解析 在1 L废水中,+6价的铬的物质的量为 mol=0.55 mol,根据氧化还原反应中电子得失数目相等可知,需要绿矾的物质的量为3×0.55 mol=1.65 mol,质量为1.65 mol×278 g.mol-1=458.7 g,A项错误;Cr2O为橙色,CrO为黄色,若颜色不变,说明反应达到平衡,B项正确;根据化学平衡常数表达式得c(CrO)=×(1-) mol.L-1=0.05 mol.L-1,c(Cr2O)=c(CrO)×=0.25 mol.L-1,再由平衡常数表达式K==1×1014,可以得到c(H+)=10-6 mol.L-1,C项正确;c(Cr3+).c3(OH-)=1×10-32,c3(OH-)==1×10-27,c(OH-)=1×10-9 mol.L-1,c(H+)=10-5 mol.L-1,pH=5,D项正确。
C组
1.某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示。下列判断正确的是( )
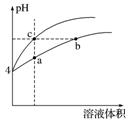
A.a、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度:a>b>c
C.b点溶液中:c(H+)+c(NH3.H2O)=c(OH-)
D.用等浓度的NaOH溶液和等体积的b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
答案 B
解析 开始盐酸与NH4Cl溶液的pH相同,可知c(NH4Cl)≫c(HCl),稀释相同倍数后,a点NH4Cl溶液中的离子浓度远大于c点盐酸的离子浓度,因而导电性不同,A错;HCl电离出的H+抑制了水的电离,所以c点溶液中水的电离程度最小,氯化铵溶液中NH的水解促进水的电离,氯化铵溶液中c(H+)越大,水的电离程度越大,综上所述a、b、c三点溶液水的电离程度a>b>c,B项正确;b点溶液中,根据质子守恒,得出c(OH-)+c(NH3.H2O)=c(H+),C项错误;b、c处溶液的pH相等,c处HCl完全电离,而b处溶液中加入NaOH溶液后,NH的水解平衡正向移动,故消耗NaOH溶液体积Vb>Vc,D项错误。
2.常温下,用0.100 mol.L-1的NaOH溶液分别滴定20.00 mL 0.100 mol.L-1的盐酸和0.100 mol.L-1的醋酸,得到两条滴定曲线,如图所示:
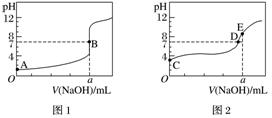
下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.两次滴定均可选择甲基橙或酚酞作指示剂
C.达到B、E点时,反应消耗的n(CH3COOH)=n(HCl)
D.以HA表示酸,当0 mL<V(NaOH)<20.00 mL时,图2对应混合液中各离子浓度由大到小的顺序一定是c(A-)>c(Na+)>c(H+)>c(OH-)
答案 C
解析 0.100 mol.L-1盐酸的pH=1,0.100 mol.L-1醋酸的pH>1,故A项错误;甲基橙的变色范围是3.1-4.4、酚酞的变色范围是8.2-10.0,由图2中pH突变的范围(>6)可知,当氢氧化钠溶液滴定醋酸时,只能选择酚酞作指示剂,B项错误;B、E两点对应消耗氢氧化钠溶液的体积均为a mL,所以反应消耗的n(CH3COOH)=n(HCl),C项正确;0 mL<V(NaOH)<20.00 mL时,图2对应混合溶液可能显中性,此时c(A-)=c(Na+)>c(H+)=c(OH-),D项错误。
3.某温度下,向一定体积0.1 mol.L-1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )
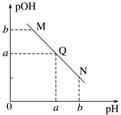
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
答案 C
解析 由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错;N点所示溶液为碱性,根据溶液电荷守恒可判断出此时c(Na+)>c(CH3COO-),B错;由于M点的H+浓度等于N点的OH-浓度,对水的电离抑制程度相同,所以两点水的电离程度相同,C正确;Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,故Q点消耗NaOH溶液的体积略小于醋酸溶液的体积,D错。
4.下图是Ca(OH)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
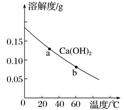
A.a点和b点的Ksp:a<b
B.向溶液a中加入CaO并恢复原温度时,溶液的pH不变
C.b点时,Ca(OH)2在水中和在NaOH溶液中的溶解度:S(H2O)>S(NaOH)
D.溶解速率:b>a
答案 A
解析 根据图像知温度越高溶解度越小,溶解平衡左移,Ca(OH)2(s)Ca2+(aq)+2OH-(aq) ΔH<0,升温,Ksp减小,A项错误;加入CaO后,平衡逆向移动,Ca(OH)2固体质量增加,但温度不变,此时溶液仍是饱和溶液,所以溶液的pH不变,B项正确;向溶液中加入少量NaOH固体,氢氧根离子浓度增大,使平衡逆向移动,Ca(OH)2固体质量增加,溶解度减小,C项正确;温度越高,溶解速率越大,D项正确。
5.标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是( )
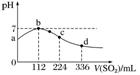
A.原H2S溶液的物质的量浓度为0.05 mol.L-1
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
答案 C
解析 A项,依据反应2H2S+SO2===3S↓+2H2O,可算出c(H2S)为0.1 mol.L-1;B项,H2S的酸性比H2SO3的弱;C项,b点溶液为中性,水的电离不受影响,而c点溶液显酸性,水的电离受到抑制;D项,H2S和H2SO3均为二元酸且d点溶液酸性比a点强,故d点溶液导电性强。
6.T ℃时,AgCl在水溶液中的沉淀溶解平衡曲线如图所示。在该温度下,下列说法中不正确的是( )
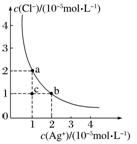
A.a点和b点对应的Ksp(AgCl)相等
B.Ksp(AgCl)=2×10-10
C.可采取蒸发溶剂的方法使溶液从c点变到b点
D.已知Ksp(AgI)=8.5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中=4.25×10-7
答案 C
解析 难溶电解质的Ksp只与温度有关,温度一定时,沉淀溶解平衡曲线上任意一点的Ksp均相等,A项不符合题意;由图可知,当c(Ag+)=1×10-5 mol.L-1时,c(Cl-)=2×10-5 mol.L-1,Ksp(AgCl)=1×10-5×2×10-5=2×10-10,B项不符合题意;蒸发溶剂时,c(Ag+)和c(Cl-)同时增大,而图中c点到b点是c(Ag+)增大,c(Cl-)不变,C项符合题意;向含KI和KCl的溶液中滴加AgNO3溶液,先产生AgI沉淀,当AgCl开始沉淀时,溶液中存在两个沉淀溶解平衡:AgI(s)Ag+(aq)+I-(aq),AgCl(s)Ag+(aq)+Cl-(aq),故====4.25×10-7,D项不符合题意。
7.电解质溶液电导率越大导电能力越强。常温下用0.100 mol.L-1盐酸分别滴定10.00 mL浓度均为0.100 mol.L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH.H2O]=1.6×10-4]。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
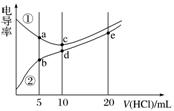
A.曲线①代表滴定二甲胺溶液的曲线
B.a点溶液中:c[(CH3)2NH]>c[(CH3)2NH.H2O]
C.d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH.H2O]
D.b、c、e三点的溶液中,水的电离程度最大的是b点
答案 C
解析 二甲胺是弱电解质,加入盐酸生成强电解质(CH3)2NH2Cl,导电性增强,因而②代表二甲胺的变化曲线,A、B均不正确;C项符合质子守恒,正确;D项,c点代表NaOH与HCl恰好完全反应,即为NaCl溶液,b点为二甲胺电离程度大于(CH3)2NH水解程度,溶液显碱性,抑制水的电离,e点盐酸过量,溶液显酸性,盐酸抑制水的电离,因而c点水的电离程度最大。
8.常温下,向20 mL 0.2 mol.L-1二元酸H2A溶液中滴加0.2 mol.L-1 NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
A.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D.当V(NaOH)=40 mL时,升高温度,减小
答案 C
解析 从图像看出当V(NaOH)=20 mL时,溶液中的溶质是NaHA,溶液中c(HA-)>c(A2-)>c(H2A),说明HA-以电离为主,故c(H+)>c(OH-),故A错;等体积等浓度的NaOH溶液与H2A溶液混合后的溶质是NaHA,HA-以电离为主,产生H+,抑制水的电离,故B错;等浓度H2A和NaHA的混合溶液形成缓冲溶液,溶液中存在电离平衡H2AH++HA-,水解平衡NaHA+H2ONaOH+H2A,加入酸,HA-会消耗H+生成H2A,加入碱,OH-和H2A反应生成HA-,溶液pH变化都不大,C正确;当V(NaOH)=40 mL时,溶液中的溶质是Na2A,但存在HA-,说明A2-水解,其水解平衡:A2-+H2OHA-+OH-,升高温度,A2-的水解平衡正向移动,c(A2-)减小,增大,故D错。