
1.人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害。人体内生成的下列酸属于无机物的是
A.乳酸(C3H6O3) B.磷酸(H3PO4)
C.丙酮酸(C3H4O3) D.乙酰乙酸(C4H6O3)
2.当光束通过下列分散系时,能观察到丁达尔效应的是
A.矿泉水 B.稀H2SO4 C.蔗糖溶液 D.Fe(OH)3胶体
|
A.大理石华表 |
B.青铜编钟 |
C.玻璃花瓶 |
D.翡翠如意 |
 |
 |
 |
 |
3.下列制品采用的材料属于合金的是
4.下列元素中,属于第 ⅣA族的是
A.钠 B.镁 C.碳 D.氮
5.电解质是一类在水溶液中或熔融状态下能够导电的化合物,下列属于电解质的是
A.酒精 B.Fe C.K2SO4 D.NaCl溶液
6.下列有机物中,属于高分子化合物的是
A.油脂 B.蔗糖 C.葡萄糖 D.蛋白质
7.下列物质中只含有离子键的是
A.Na2O B.CO2 C.H2 D.NaOH
8.下列诗句描述的过程包含化学变化的是
A.千锤万凿出深山 B.雪融山顶响流泉
C.吹尽狂沙始到金 D.蜡炬成灰泪始干
9.下列化学用语正确的是
A.氯化钠的电子式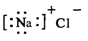 B.乙烯的结构式H-C=C-H
B.乙烯的结构式H-C=C-H
C.磷原子的结构示意图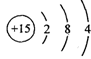 D.乙酸的分子式C2H4O2
D.乙酸的分子式C2H4O2
10.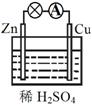 原电池原理的发现极大地推进了现代化的进程,改变了人们的生活方式。关于下图所示原电池的说法不正确的是
原电池原理的发现极大地推进了现代化的进程,改变了人们的生活方式。关于下图所示原电池的说法不正确的是
A.锌片上发生的反应为Zn - 2e = Zn2+
B.Cu为负极,Zn为正极
C.电子由锌片通过导线流向铜片
D.该装置使氧化反应和还原反应分别在两个不同的区域进行
11.氨是化肥工业和基本有机化工的主要原料。随着科学技术的发展,对氨的需要量日益增长。合成氨反应的化学方程式如下:N2 (g) + 3H2 (g) 2NH3(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
2NH3(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
A.H2、N2、NH3的浓度均不再变化
B.正、逆反应速率相等且都等于零
C.每消耗1mol N2的同时,有2mol NH3生成
D.H2、NH3、N2在容器中共存
12.“玉兔”号月球车用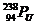 作为热源材料。下列关于
作为热源材料。下列关于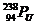 的说法正确的是
的说法正确的是
A. 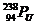 与
与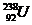 互为同位素
B.
互为同位素
B. 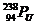 的原子序数是238
的原子序数是238
C. 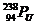 与
与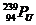 最外层电子数相同 D.
最外层电子数相同 D. 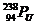 与
与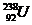 化学性质相同
化学性质相同
13.对于反应中的能量变化,表述正确的是
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应
14.下列属于加成反应的是
A.苯与硝酸反应生成硝基苯 B.乙烯与氯化氢反应生成氯乙烷
C.甲烷与氯气反应生成一氯甲烷 D.乙酸与乙醇反应生成乙酸乙酯
15.糖类、油脂和蛋白质是生命活动所必需的营养物质。其中不能发生水解反应的是
A.植物油 B.葡萄糖 C.淀粉 D.蛋白质
16.同一主族从上到下,有关卤族元素的说法正确的是
A.原子半径逐渐增大
B.单质氧化性逐渐增强
C.元素非金属性逐渐增强:]
D.都有最高价氧化物的水化物,化学式为HXO4
17.既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是
A.在一定条件下通入H2 B.通入足量氢氧化钠溶液中
C.通入足量溴水中 D.分别进行燃烧
18.下列有关物质用途的说法中,正确的是
① 用明矾来消毒水 ②用BaCO3 来作钡餐
③ 碳酸氢钠可用于治疗胃酸过多 ④铝合金可用于制造飞机
A.①②③④都正确 B.只有②③④ C.只有③④ D.只有①②
19.下列有关物质性质的比较中,正确的是
A.还原性:Al>Na B.碱性:KOH>NaOH
C.酸性:H2SO4>HClO4 D.稳定性:HI>HCl
20.已知反应:Zn + H2SO4 ZnSO4+H2↑,下列条件下反应速率最快的是
ZnSO4+H2↑,下列条件下反应速率最快的是
|
选项 |
温度 |
锌的质量和形状 |
硫酸的体积和浓度 |
|
A. |
25℃ |
2g薄片 |
10 mL、0.2 mol/L |
|
B. |
25℃ |
2g薄片 |
20 mL、0.1 mol/L |
|
C. |
50℃ |
2g粉末 |
50 mL、0.1 mol/L |
|
D. |
50℃ |
2g粉末 |
10 mL、0.2 mol/L |
21.化学反应常伴有颜色变化,下列实验现象描述不正确的是
A.将足量乙烯通入酸性高锰酸钾溶液中,紫色溶液逐渐褪色
B.往葡萄糖溶液中加入新制氢氧化铜悬浊液并加热,产生砖红色沉淀
C.将干燥的红色布条放入盛有氯气的集气瓶中,布条褪色
 D.向鸡蛋清溶液中滴入几滴浓硝酸,微热,溶液颜色变黄
D.向鸡蛋清溶液中滴入几滴浓硝酸,微热,溶液颜色变黄
22.关于碳循环的说法不正确的是
A.氧元素也参与了碳循环
B.绿色植物可吸收大气中CO2
C.大量燃烧化石燃料会造成温室效应
D.在呼吸和光合作用时碳元素均被氧化
23.下列说法中,正确的是
A.1 mol CH4的质量是16 g
B.标准状况下,1 mol H2O的体积是22.4 L
C.17 g NH3含有的氢原子总数为6.02×1023
D.100 mL 0.1 mol/L Na2CO3溶液中,Na+的物质的量为 0.01 mol
24.下列反应的离子方程式正确的是
A.铁与硫酸铜溶液反应:Fe+Cu2+ Cu+Fe 3+
Cu+Fe 3+
B.铜与稀硝酸反应:Cu + 4H++2NO3- Cu2++ 2NO2↑+ 2H2O
Cu2++ 2NO2↑+ 2H2O
C.铝与氢氧化钠溶液反应:2Al + 2OH-+2H2O  2AlO2- + 3H2↑
2AlO2- + 3H2↑
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+ H++ OH- BaSO4↓+ H2O
BaSO4↓+ H2O
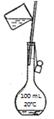
25.完成下列实验所选择的装置或试剂不正确的是
|
|
A |
B |
C |
D |
|
实验 |
配制 100 mL 1 mol/L NaCl溶液 |
提取碘水中的碘 |
制备氨气 |
除去二氧化碳中的氯化氢 |
|
装置 |
 |
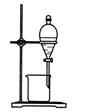 |
 |
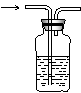 |
|
试剂 |
NaCl固体、蒸馏水 |
碘水、CCl4 |
NH4Cl和Ca(OH)2固体 |
NaOH溶液 |
第Ⅱ卷 非选择题 (共50分)
1.(3分)氨的催化氧化是工业制硝酸的基础,其反应原理是4NH3+5O2 4NO+6H2O。在该反应中,氧化剂是_________(填化学式),被氧化的物质是_________(填化学式);若反应中消耗了2mol NH3,则生成_________molNO。
4NO+6H2O。在该反应中,氧化剂是_________(填化学式),被氧化的物质是_________(填化学式);若反应中消耗了2mol NH3,则生成_________molNO。
2.(3分)铁元素是人体内一种微量元素,主要以Fe2+的形式存在。请回答下列问题:
(1)下列微粒中,既有氧化性又有还原性的是_________(填字母)。
A.Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,此过程显示维生素C具有_________性。
(3)含硫酸亚铁的药片可治疗缺铁性贫血,其表面有糖衣,糖衣的作用是_________。
3.(4分)2016年9月G20峰会在杭州举行。
(1)峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于_________(填字母,下同)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
(2)峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是_________。
a.防治酸雨 b.降低温室效应 c.保护臭氧层
(3)央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是_________。

a.可以溶于盐酸
b.相比纯金币,熔点高
c.相比纯金币,硬度大
(4)为迎接G20峰会,浙江省加大了对环境治理的力度,特别是对氮氧化物的治理。下列有关说法正确的是_________(填字母)。
a.NO是无害气体,NO2是有害气体
b.氮氧化物会造成硝酸型酸雨的危害
c.汽车尾气排放会产生大量氮氧化物,在汽车尾气系统中加装催化转化装置可有效降低尾气中氮氧化物的含量
d.NO和NO2都难溶于水
4.(4分)现有下列4种物质:① Al2O3、②SiO2、③ Na2SO3、④ NH3。其中,与氢氧化钠溶液反应生成水玻璃的是_________(填序号,下同);焰色反应呈黄色的是_________;与水反应得到的水溶液能使紫色石蕊溶液呈蓝色的是_________;既能与盐酸又能与NaOH溶液反应的是_________。
5.(4分)研究雾霾的成因有利于我们更有效地治理环境问题。虽然人们早已了解,雾霾可能是由于燃煤排放造成的,但其确切的化学过程在过去几十年并未被完全揭示。由美国、中国、以色列和英国研究人员组成的实验团队,通过实验室实验和在中国进行的大气测量,初步发现了中国雾霾的化学反应过程,并在最新一期的《美国国家科学院院刊》上发表研究成果,揭示了“中国霾”的成因。
中国霾是尺寸很小的纳米颗粒,且呈中性。在中国,二氧化硫主要来源于发电厂燃煤排放的废气,二氧化氮主要来源于发电厂和汽车尾气,二氧化氮的存在会加快二氧化硫转化为硫酸的进程。而空气中的氨,绝大多数来自肥料的使用和汽车尾气的排放,它会与硫酸发生中和反应形成硫酸盐,这些物质的相互作用导致了中国的雾霾。因此,减少氮氧化物和氨氮的排放,或是遏制硫酸盐形成进而减少雾霾的有效之道。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)引起中国霾的有害气体有SO2、NO2、NH3等。_________
(2)SO2的主要来源是发电厂含硫煤炭的燃烧。_________
(3)NO2的主要来源是肥料的使用。_________
(4)可通过减少汽车尾气排放来减少氮氧化物的产生。_________
6.(8分)某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。
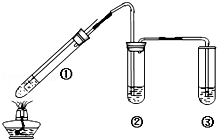 (1)①中铜与浓硫酸反应的化学方程式是_________。
(1)①中铜与浓硫酸反应的化学方程式是_________。
(2)②中品红溶液的现象是_________。
(3)③中NaOH溶液的作用是_________。
(4)①中铜丝可以上下抽动,其目的是_________。
7.(8分)A、B、C、D、E是中学化学常见的物质。其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体。其转化关系如下:
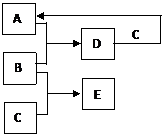
(1)若E是淡黄色粉末,能与D反应生成B。
① 组成C的元素在周期表中的位置是_________。
② 当E与D反应,转移1 mol电子时,生成B的质量为_________。
(2)若E是黑色、有磁性固体。
① C与D反应的化学方程式为_________。
② 下列关于E与稀盐酸反应的说法正确的是_________(填字母序号)。
a. 二者发生氧化还原反应
b. 反应后所得溶液能使酸性KMnO4溶液褪色
c. 向反应后溶液中加入NaOH溶液,能观察到白色沉淀
d. 向反应后溶液中加入KSCN溶液,能观察到溶液呈血红色
8. (8分)铁硅铝合金制成的磁粉芯在高频下具有较好的磁性和较低的损耗,所以被用作新型电子节能材料。由于铝、硅的含量影响铁硅铝合金的性能,某研究小组同学欲测定该合金中铝的含量,设计了如下实验。
(8分)铁硅铝合金制成的磁粉芯在高频下具有较好的磁性和较低的损耗,所以被用作新型电子节能材料。由于铝、硅的含量影响铁硅铝合金的性能,某研究小组同学欲测定该合金中铝的含量,设计了如下实验。
请回答:
(1)①~③所涉及的实验操作方法中,用到过滤的是_________(填序号)。
(2)①中发生反应的离子方程式是_________。
(3)下列说法正确的是_________(填字母)。
a.溶液C含有3种阴离子
b.③中发生了氧化还原反应
c.②中的氢氧化钠溶液可用氨水代替
(4)若红棕色固体E为纯净物,则合金中铝的质量分数为_________。
9.(8分)辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
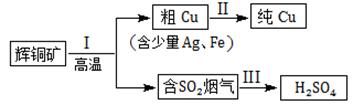
(1) Cu2S(硫化亚铜)中Cu元素的化合价是_________价。
(2)冶炼过程中产生的SO2气体如果直接排放到空气中,会形成酸雨,请写出SO2在空气中转化形成硫酸型酸雨的反应方程式_________,_________。
(3)过程I中产生的烟气除了含有SO2气体,还含有少量CO2气体。
①检验烟气中的CO2气体需先将SO2气体除去。为保证CO2气体的检验,除去SO2气体可选用的试剂是_________(填序号)。
A.NaOH溶液 B.KMnO4酸性溶液
②将过程I产生的烟气通入一定量的NaOH溶液中,得到的溶液显中性,其中包括的离子及浓度如下所示(其他离子忽略不计):
|
所含离子 |
Na+ |
HCO3- |
CO32- |
SO32- |
HSO3- |
|
浓度mol/L |
|
0.005 |
0.01 |
0.05 |
0.2 |
则c(Na+)=_________mol/L。
丰台区2017-2018学年度第一学期期中联考
丰台区2017-2018学年度第一学期期中考试联考 高二化学(文科卷) (考试时间 90分钟 满分100分) 可能用到的相对原子质量:Na-23 C-12 O-16 N-14 H-1 Al-27 Si-28 Fe-56 第Ⅰ卷 选择题 (共50分) 下列各题的四个选项中,只有一个选项符合题意,每题2分。参考答案
高二化学(文科卷)参考答案
第Ⅰ卷 选择题(每小题2分,共50分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
B |
D |
B |
C |
C |
D |
A |
D |
D |
B |
A |
C |
A |
|
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
B |
B |
A |
C |
C |
B |
D |
C |
D |
A |
C |
D |
|
第II卷 非选择题(共50分)
1.(3分) O2 ;NH3;2。(每空1分)
2.(3分) (1)B;(2)还原;(3)保护硫酸亚铁不被空气中的氧气氧化。(每空1分)
3.(4分) (1)b;(2)c;(3)c;(4)bc。(每空1分)
4.(4分) ②;③;④;①。(每空1分)
5.(4分) (1)对;(2)对;(3)错;(4)对。(每空1分)
6.(8分)(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;(2)红色褪去;
CuSO4+SO2↑+2H2O;(2)红色褪去;
(3)吸收多余的二氧化硫,防止污染环境;
(4)可通过抽拉铜丝调节其与浓硫酸反应的发生与停止。(每空2分)
7.(8分)(1)① 第3周期 第IA族 ;② 16 g ;
(2)①3Fe+4H2O(g) Fe3O4+4H2↑;② b d。(每空2分)
Fe3O4+4H2↑;② b d。(每空2分)
8.(8分)(1)① ② ;(2)Fe + 2H+  Fe2+ + H2↑、2Al + 6H+
Fe2+ + H2↑、2Al + 6H+  2Al3+
+ 3H2↑;
2Al3+
+ 3H2↑;
(3)a b;(4)7.3%(或0.073)。(方程式每个1分,其余每空2分)
9.(8分)(1)+1;(2)SO2+H2O===H2SO3;2 H2SO3+O2===2H2SO4;
(3)① B ;② 0.325。(方程式每个1分,其余每空2分)