
6.晶体结构的计算
[考点归纳]
1.晶胞化学式的计算
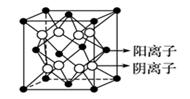
晶体中微粒的排列具有周期性,晶体中最小的结构重复单元称为晶胞,利用“均摊法”可以计算一个晶胞中的粒子数,从而确定晶体的化学式。“均摊法”的基本思想是晶胞中任意位置上的一个粒子被n个晶胞共用,那么每个晶胞对这个原子分得份额就是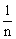 。常见考题里涉及的晶胞有立方晶胞、六方晶胞、三棱晶胞,以立方晶胞最为常见。
。常见考题里涉及的晶胞有立方晶胞、六方晶胞、三棱晶胞,以立方晶胞最为常见。
(1)立方晶胞:每个顶点上的粒子被8个晶胞共用,每个粒子只有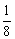 属于该晶胞;每条棱上的粒子被4个晶胞共用,每个粒子只有
属于该晶胞;每条棱上的粒子被4个晶胞共用,每个粒子只有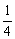 属于该晶胞;每个面心上的粒子被2个晶胞共用,每个粒子只有
属于该晶胞;每个面心上的粒子被2个晶胞共用,每个粒子只有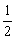 属于该晶胞;晶胞内的粒子完全属于该晶胞。
属于该晶胞;晶胞内的粒子完全属于该晶胞。
(2)六方晶胞:每个顶点上的粒子被6个晶胞共用;每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用;每个面心上的粒子被2个晶胞共用;晶胞内的粒子完全属于该晶胞。
(3)三棱晶胞:每个顶点上的粒子被12个晶胞共用;每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被6个晶胞共用;每个面心上的粒子被2个晶胞共用;晶胞内的粒子完全属于该晶胞。
2.晶体密度及微粒间距离的计算
(1)晶体微粒与M、ρ之间的关系:若1个晶胞中含有x个微粒,则1mol晶胞中含有xmol微粒,其质量为xMg(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3g(a3为晶胞的体积,ρ为晶胞的密度),则1mol晶胞的质量为ρa3NAg,因此有xM=ρa3NA。
(2)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a):面对角线长=a;体对角线长=a;体心立方堆积4r=a(r为原子半径);面心立方堆积4r=a(r为原子半径)。
(3)空间利用率的计算:空间利用率=。
[过关练习]
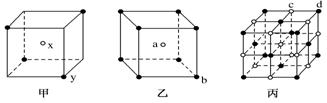
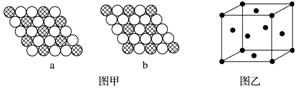
1.下图是甲、乙、丙三种晶体的晶胞,则甲晶体中x与y的个数比是______,乙中a与b的个数比是______,丙中一个晶胞中有________个c离子和________个d离子。
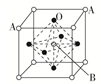
2.某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。用A、B、O表示这类特殊晶体的化学式:________。
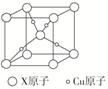
3.下图是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)________;与X等距离且最近的X原子个数为________。
4.钒的某种氧化物晶胞结构如图所示。该氧化物的化学式为________,若它的晶胞参数为x nm,则晶胞的密度为________g.cm-3。
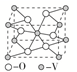
5.某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
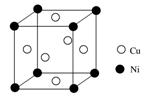
6.Z基态原子的M层与K层电子数相等,它与某元素形成的化合物的晶胞如下图所示,晶胞中阴离子和阳离子的个数之比是________。
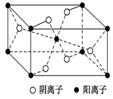
7.M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。M与Y形成的一种化合物的立方晶胞如图所示。该化合物的化学式为________,已知晶胞参数a=0.542 nm,此晶体的密度为________g.cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
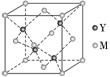
8.O原子和Na原子能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566 nm, F的化学式为________:晶胞中O原子的配位数为______________;列式计算晶体F的密度(g.cm-3)____________________。

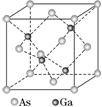
9.GaAs的熔点为1 238 ℃,密度为ρg.cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag.mol-1和MAsg.mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________________________。
10.Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂。Ni(CO)4固态时属于________晶体(填晶体类型)。Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为________。
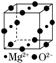
11.下图所示的CaF2晶体中与Ca2+最近且等距离的F-数为________,已知,两个距离最近的Ca2+核间距离为a×10-8cm,计算CaF2晶体的密度为________________。
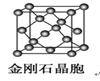
12.金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=______a,列式表示碳原子在晶胞中的空间占有率_________(不要求计算结果)。
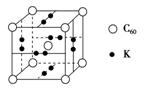
13.科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为________。继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点Si60>N60>C60,而破坏分子所需要的能量N60>C60>Si60,其原因是_________。
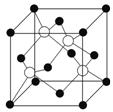
14.如图甲所示为二维平面晶体示意图,所表示的物质化学式为AX3的是________(填“a”或“b”)。图乙为金属铜的晶胞,此晶胞立方体的边长为a pm,金属铜的密度为ρg.cm-3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
15.FeO、NiO的晶体结构与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm,则熔点FeO___(填“<”、“>”或“=”)NiO,原因是_____________。磷化硼是一种超硬耐磨的涂层材料,其晶胞如图2所示。P原子与B原子的最近距离为acm,则磷化硼晶胞的边长为________cm(用含a的代数式表示)。
高三化学 考点点点过 6.晶体结构的计算(选修3)参考答案
参考答案
1.[解析]甲中N(x)∶N(y)=1∶=2∶1;乙中N(a)∶N(b)=1∶=1∶1;丙中N(c)=12×+1=4,N(d)=8×+6×=4。
[答案]2∶1 1∶1 4 4
2.[解析]由图可知,晶胞中A位于顶点,晶胞中含有A为8×=1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×=3则化学式为ABO3。
[答案]ABO3
3.[解析]晶胞中含有X原子数目=8×+1=2,含有Cu:4,晶胞的化学式Cu2X;根据晶胞结构,与X等距离且最近的X原子个数为8个。
[答案]Cu2X 8
 [答案]VO2
[答案]VO2
5.[解析]Cu原子位于面心,个数为6×=3,Ni原子位于顶点,个数为8×=1,铜原子与镍原子的数量比为3∶1。
[答案]3∶1
6.2:1
7.[解析]根据晶胞结构利用切割法分析,每个晶胞中含有铜原子个数为8×+6×=4,氯原子个数为4,该化合物的化学式为CuCl;则1 mol晶胞中含有4 mol CuCl,1 mol晶胞的质量为4×99.5 g,又晶胞参数a=0.542 nm,此晶体的密度为g.cm-3。
[答案]CuCl
8.[解析]O2-半径大于Na+半径,由F的晶胞结构可知,大球代表O2-,小球代表Na+,每个晶胞中含有O2-个数为8×+6×=4,含有Na+个数为8,故O2-、Na+离子个数之比为4∶8=1∶2,从而推知F的化学式为Na2O。由晶胞结构可知,每个O原子周围有8个Na原子,故O原子的配位数为8。晶胞参数a=0.566 nm=0.566×10-7 cm,则晶胞的体积为(0.566×10-7cm)3,从而可知晶体F的密度为≈2.27 g.cm-3。
[答案] Na2O 8 ≈2.27g.cm-3
9.[解析]GaAs的熔点为1 238 ℃,其熔点较高,据此推知GaAs为原子晶体,Ga与As原子之间以共价键键合。分析GaAs的晶胞结构,4个Ga原子处于晶胞体内,8个As原子处于晶胞的顶点、6个As原子处于晶胞的面心,结合“均摊法”计算可知,每个晶胞中含有4个Ga原子,含有As原子个数为8×+6×=4(个),Ga和As的原子半径分别为rGapm=rGa×10-10cm,rAspm=rAs×10-10 cm,则原子的总体积为V原子=4×π×[(rGa×10-10cm)3+(rAs×10-10cm)3]=×10-30(r+r)cm3。又知Ga和As的摩尔质量分别为MGag.mol-1和MAsg.mol-1,晶胞的密度为ρg.cm-3,则晶胞的体积为V晶胞=cm3,故GaAs晶胞中原子的体积占晶胞体积的百分率为×100%=×100%=×100%。
[答案]原子晶体 共价×100%
 [答案]分子 Mg2NiO3
[答案]分子 Mg2NiO3
11.[解析]CaF2晶体中Ca2+的配位数为8,F-的配位数为4,Ca2+和F-个数比为1∶2,一个晶胞中实际拥有的Ca2+为8×+6×=4,F-为8个,晶胞顶点及六个面上的离子为Ca2+,晶胞内部的离子为F-,1个晶胞实际拥有4个“CaF2”。则CaF2晶体的密度:4×78 g.mol-1÷[(a×10-8 cm)3×6.02×1023mol-1]= g.cm-3。
[答案]8 g.cm-3
12.由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,晶胞中C原子数目为4+6×+8×=8;若C原子半径为r,金刚石的边长为a,根据硬球接触模型,则正方体对角线长度的就是C-C键的键长,即a=2r,所以r=a,碳原子在晶胞中的空间占有率w===。
[答案]8 =
13.3∶1结构相似的分子晶体的相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子需要的能量大小顺序为N60>C60>Si60
14.b ×1030
15.< FeO和NiO相比,阴离子相同,阳离子所带电荷相同,但亚铁离子半径大于镍离子,所以FeO晶格能小,熔点低