1.下列微粒中不存在配位键的是 ( )。
A.SiH4 B.NH4+
C.H3O+ D.[Fe(SCN)6]3-
答案 A
2.下列不属于配位化合物的是 ( )。
A.六氟合铝酸钠 B.氢氧化二氨合银
C.六氰合铁酸钾 D.十二水硫酸铝钾
解析 解此类题方法较为灵活,从四个选项中看,我们对十二水硫酸铝钾很
熟悉,而对其余三种较为陌生,而D选项物质是由K+、Al3+、SO42-及H2O
分子组成的离子化合物,所以D肯定不是配位化合物。A选项物质俗称冰晶
石,是电解法制铝的助熔剂;C选项物质俗称黄血盐,可用于检验Fe3+。
答案 D
3.如图是卟啉配合物叶绿素的结构示意图(部分),有关的叙述正确的是( )。
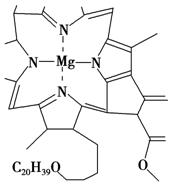
A.该叶绿素只含有H、Mg、C、N元素
B.该叶绿素是配合物,中心离子是镁离子
C.该叶绿素是配合物,其配体是N元素
D.该叶绿素不是配合物,而是高分子化合物
解析 Mg的最高化合价为+2,而化合物中Mg与4个氮原子作用,由此可
以判断该化合物中Mg与N原子间形成配位键,该物质为配合物,B项正确、
D项错误;该化合物组成中还含有氧元素,故A项错;该化合物中配位原子
为N原子,而不能称为配体,同样也不能称配体是氮元素,因为配体一般可
以是离子或分子。
答案 B
4.一种被称为联氨或肼的易溶于水的液体,它的分子式是N2H4,试分析其结构和性质。
(1)写出联氨分子的结构式。
(2)a mol N2H4所能结合的H+的物质的量为多少?N2H4是通过什么形式的
化学键来结合H+的?
(3)写出联氨与相等物质的量的硫酸的反应,生成可溶性离子化合物(硫酸
肼)的离子方程式。
答案 (1)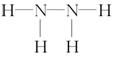 (2)2a
mol 配位键 (3)N2H4+2H+===N2H62+
(2)2a
mol 配位键 (3)N2H4+2H+===N2H62+
考查点二 配合物的形成
5. 向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是( )。
A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2
解析 配合物的内界与外界由离子键结合,只要外界存在Cl-,加入AgNO3
溶液即有AgCl沉淀产生。对于B项配合物分子[Co(NH3)3Cl3],Co3+、NH3、
Cl-全处于内界,很难电离,不存在Cl-,所以不生成AgCl沉淀。
答案 B
6. 向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,下列关于实验现象的叙述不正确的是 ( )。
A.先生成白色沉淀,加入足量氨水后沉淀消失
B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl-
C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl
D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后又消
失
解析 Ag+与NH3能发生如下反应:Ag++2NH3===[Ag(NH3)2]+,而AgCl
存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),向其中滴加氨水
后会使平衡向右移动,最终因生成[Ag(NH3)2]Cl而溶解。
答案 B
7. 为何AgI不能溶于氨水中,却能溶于KCN中?
答案 因为AgI溶解度很小,溶于氨水生成的[Ag(NH3)2]OH稳定性差,
所以AgI不溶于氨水,而溶于KCN生成稳定性很强的[Ag(CN)2]-配离子,
使平衡向AgI溶解的方向移动,所以AgI可溶于KCN溶液。反应方程式:
AgI+2CN-===[Ag(CN)2]-+I-
考查点三 配合物的结构
8. Co(Ⅲ)的八面体配合物CoClm.nNH3,若1 mol配合物与AgNO3作用生成
1 mol AgCl沉淀,则m、n的值是 ( )。
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=4,n=5
解析 由1 mol配合物生成1 mol AgCl沉淀,知道1 mol配合物电离出1 mol
Cl-,即配离子显+1价,又因为外界有一个Cl-,且Co显+3价,所以
[CoClm-1.nNH3]+中有两个氯原子,又因为是正八面体,所以n=6-2=4。
答案为B。
答案 B
9. 写出[Ag(NH3)2]OH的中心原子、配位体、配位数,并写出电离方程式。
解析 [Ag(NH3)2]OH的中心原子是Ag+,配位体是NH3,配位数是2,由
于配合物的内界是以配位键形成的,一般不电离,而内界和外界之间是通过
离子键相结合的,可以完全电离。所以电离方程式为:
[Ag(NH3)2]OH===[Ag(NH3)2]++OH-。
答案 中心原子:Ag+ 配位体:NH3 配位数:2
电离方程式:[Ag(NH3)2]OH===[Ag(NH3)2]++OH-
10. 某物质的实验式为PtCl4.2NH3,其水溶液不导电,加入AgNO3也不产生沉淀,用强碱处理并没有NH3放出,写出它的配位化学式。
解析 实验式为PtCl4.2NH3的物质,其水溶液不导电说明它不是离子化合
物,在溶液中不能电离出阴、阳离子。加入AgNO3不产生沉淀,用强碱处理
没有NH3放出,说明不存在游离的氯离子和铵根离子,所以该物质的配位化
学式为[PtCl4(NH3)2]。
答案 [PtCl4(NH3)2]
11.已知气态氯化铝分子以双聚形式存在,其结构式如下所示:
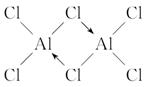
图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享。又知H3BO3为
白色固体,溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的
电离平衡解释它只是一元酸的原因,请写出下面这个方程式右端的两种离子
的表达式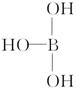 +H2O + 。
+H2O + 。
解析 H3BO3为一元弱酸,其分子中的B原子有空轨道,H2O电离产生的
OH-中O原子有孤电子对,则B原子与O原子形成配位键,形成
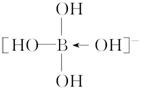 ,产生H+,即
,产生H+,即

答案 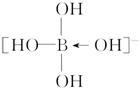 H+
H+
12. 写出下列反应的离子方程式:
(1)AgNO3溶液中逐滴加入氨水至过量;
(2)硫酸铜溶液逐滴加入氨水至过量;
(3)AgCl固体溶于氨水;
(4)FeCl3溶液与NH4SCN溶液混合。
答案 (1)Ag++NH3.H2O===AgOH↓+NH4+
AgOH+2NH3.H2O===[Ag(NH3)2]++OH-+2H2O
(2)Cu2++2NH3.H2O===Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3.H2O===[Cu(NH3)4]2++2OH-+4H2O
(3)AgCl+2NH3.H2O===[Ag(NH3)2]++Cl-+2H2O
(4)Fe3++SCN-===[Fe(SCN)]2+
13. 元素周期表中第4周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第4周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍
[Ni(CO)4]。CO分子中C原子上有一对孤电子对,C、O原子都符合8电
子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为
(填化学式)。
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423 K时,
Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4
易溶于下列 。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低
于Zn,原因是______________________________________________________
_________________________________________________________________。
(3)用价层电子对互斥模型预测H2Se和BBr3的立体结构,两个结论都正确
的是 。
a.直线形;三角锥型 b.V形;三角锥型
c.直线形;平面三角形 d.V形;平面三角形
(4)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有
关。
①Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极
性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类
型)。
②CuSO4.5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水
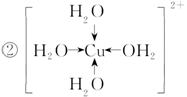
合铜离子的结构简式(必须将配位键表示出来)________________________。
解析 (1)①由题意可知CO的结构式为C O;与CO互为等电子体的
O;与CO互为等电子体的
离子是CN-。②Ni(CO)4为非极性分子,根据相似相溶规则,Ni(CO)4
易溶于非极性溶剂四氯化碳和苯。
(2)Zn的最外层4s2已达到全充满的稳定状态,而Ga易失去1个电子后内
层电子达到全充满的稳定状态,所以Ga的第一电离能明显低于Zn。
(3)根据价层电子对互斥模型可推测出H2Se和BBr3的立体结构分别为V
形、平面三角形。
(4)①Fe(CO)5熔、沸点低,常温下呈液态,从而可判断其晶体为分子晶
体。②1个Cu2+与4个H2O分子形成了[Cu(H2O)4]2+。
答案 (1)①C  O CN- ②bc
O CN- ②bc
(2)1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1 Ga失去1个电子后内层电子
达到全充满的稳定状态
(3)d
(4)①分子晶体