
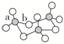
1.(2015.安徽卷)碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图所示。下列有关该物质的说法正确的是( )

A.分子式为C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6 g该物质完全燃烧得到6.72 L CO2
[解析] A项,由图示可知,该物质的分子式为C3H2O3。B项,分子中碳碳双键和碳氧双键中各有一个σ键,碳氧单键全部是σ键(4个),碳氢键也是σ键(2个),共有8个σ键。C项,分子中的碳氧键、碳氢键都是极性键,而碳碳键是非极性键。D项,8.6 g该物质的物质的量为0.1 mol,完全燃烧后得到0.3 mol CO2,只有在标准状况下0.3 mol CO2的体积才是6.72 L。
[答案] A
2.374 ℃、22.1 MPa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水( )
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
[解析] 超临界水仍然呈中性,pH不等于7,A、C项错误,根据“相似相溶”原理可以知B正确(有机物大多数是非极性分子),D错误。
[答案] B
3.下列说法中正确的是( )
A.HCHO分子中既含σ键又含π键
B.CO2分子中的化学键为非极性键
C.NH3分子中N原子的杂化轨道类型是sp2
D.沸点:PH3>NH3>H2O
[解析] HCHO分子中含有碳氧双键,既含σ键又含π键,A项正确;CO2分子中的化学键是极性键,B不正确;NH3分子中N原子的杂化轨道类型是sp3杂化,C项不正确;氨气分子之间存在氢键,因而氨的沸点反常高,由于水分子之间的氢键强于氨气分子之间的氢键,因此水的沸点高于氨的沸点,D项不正确。
[答案] A
4.在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
[解析] 由石墨的晶体结构知C原子为sp2杂化,故B原子也为sp2杂化,但由于B(OH)3中B原子与3个羟基相连,羟基间能形成氢键,故同层分子间的主要作用力为氢键。
[答案] C
5.PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是( )
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P-H键键能低
D.PH3分子稳定性低于NH3分子,是因为N-H键键能高
[解析] PH3与NH3构型相同,因中心原子上有一对孤电子对,均为三角锥形,属于极性分子,A、B项正确;PH3的沸点低于NH3,是因为NH3分子间存在氢键,C项错误;PH3的稳定性低于NH3,是因为N-H键键能高,D项正确。
[答案] C
6.(2017.黄冈调研)已知O3分子为V形结构,关于相同条件下O3和O2在水中溶解度的比较,下列说法正确的是( )
A.O3在水中的溶解度和O2一样
B.O3在水中的溶解度比O2小
C.O3在水中的溶解度比O2大
D.无法比较
[解析] O3分子为V形结构,不对称为极性分子,而O2为非极性分子,水是极性溶剂,根据相似相溶原理可知,O3在水中的溶解度比O2大。
[答案] C
7.(1)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子______________________。
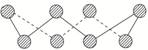
(2)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是________对,分子的立体构型为________;SO3气态为单分子,该分子中S原子的杂化轨道类型为________;SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为________;该结构中S-O键长有两类,一类键长约140 pm,另一类键长约为160 pm,较短的键为________(填图中字母),该分子中含有________个σ键。
(3)S的氢化物(H2S)分子的空间构型为________。
(4)①与OH-互为等电子体的一种分子为________(填化学式)。
②醛基中碳原子的轨道杂化类型是________;1 mol乙醛分子中含有的σ键的数目为________。
(5)BCl3和NCl3中心原子的杂化类型分别为________和________。
(6)已知元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍,则在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________,YZ的空间构型为________。
(7)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________。
(8)甲醛(H2C===O)在Ni催化作用下加氢可得甲醇(CH3OH),甲醇分子内C原子的杂化方式为________,甲醇分子内的O-C-H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角。
[解析] (1) CS2分子中,存在σ键和π键。CS2分子中,C原子的价层电子对数为2,杂化轨道类型为sp。根据等电子理论,与CS2具有相同空间构型和键合形式的分子有CO2、COS和N2O,离子有NO、SCN-。(2)SO2分子中S原子价电子排布式为3s23p4,价层电子对数是3对,分子的立体构型为V形;SO3气态为单分子,该分子中S原子的杂化轨道类型为sp2杂化;SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为sp3杂化;该结构中S-O键长有两类,一类键长约140 pm,另一类键长约为160 pm,较短的键为a,该分子中含有12个σ键。(3)H2S的结构类似于H2O,为V形。(4)①OH-有2个原子,10个电子,与其互为等电子体的分子是HF。②乙醛中甲基的C原子是sp3杂化,醛基的C原子是sp2杂化,一个乙醛分子中4个C-H σ键,1个C-C σ键,1个C-O σ键,共6个σ键。(5)BCl3中B原子3个价电子全部成键,杂化类型为sp2,NCl3中N原子有一个孤电子对,N的杂化类型为sp3。(6)Y基态原子的3p轨道上有4个电子,Y为S元素,元素Z的原子最外层电子数是其内层的3倍,Z是O元素。H2S中S原子的杂化方式为sp3,SO的空间构型为正四面体。(7)S8中每个S原子连接2个S原子,S原子还有2个孤电子对,所以S的杂化方式为sp3。(8)甲醇中碳原子形成四个σ键,为sp3杂化,甲醇分子内O-C-H键角接近109°28′,甲醛分子的空间构型为平面形,键角接近120°。
[答案] (1)σ键和π键 sp CO2、SCN-(或COS等)
(2)3 V形 sp2 sp3 a 12 (3)V形
(4)①HF ②sp2 6NA (5)sp2 sp3
(6)sp3 正四面体 (7)sp3 (8)sp3 小于
8.(1)(2015.新课标全国卷Ⅰ节选)①碳在形成化合物时,其键型以共价键为主,原因是______________________。
②CS2分子中,共价键的类型有______、C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型和键合形式的分子或离子________________。
(2)化合物Cl2O的立体构型为________,中心原子的价层电子对数为________,Cl2与湿润的Na2CO3反应可制备Cl2O,其化学方程式为_________。
(3)1 mol乙醛分子中含有σ键的数目为________,乙酸的沸点明显高于乙醛,其主要原因是___________________________。
(4)已知a是H,b是N,c是O,d是S,a与元素b、c、d形成的二元共价化合物中,分子中既含有极性共价键,又含有非极性共价键的化合物是_______(填化学式,写出两种)。
[答案] (1)①C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构
②σ键和π键 sp CO2、SCN-(或COS等)
(2)V形 4
2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl)
(3)6NA CH3COOH分子间存在氢键
(4)H2O2 N2H4
B级(能力提升)
1.下列推论正确的是( )
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.NH为正四面体结构,可推测PH也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
[解析] A项,NH3分子间存在氢键,其沸点高于PH3;B项,N、P同主族,PH与NH结构相似;C项,SiO2是原子晶体;D项,C3H8中两个C-C键的夹角不是180°,不是直线形的分子。
[答案] B
2.(2017.襄阳模拟)关于CS2、SO2、NH3三种物质的说法中正确的是( )
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,所以在三种物质中熔沸点最低
D.NH3在水中溶解度很大只是由于NH3分子有极性
[解析] A.CS2与二氧化碳相似,都是直线形分子,为非极性分子,而水是极性溶剂,根据相似相溶原理,则二硫化碳在水中的溶解度不大,错误;B.二氧化硫为V形分子,氨气为三角锥形分子,都是极性分子,所以易溶于水,正确;C.二硫化碳为非极性分子,常温下为液体,但二氧化硫、氨气在常温下均为气体,所以二硫化碳的熔沸点最高,错误;D.氨气在水中的溶解度大不仅仅是因为氨气分子有极性,还因为氨气与水分子间能形成氢键,增大氨气的溶解度,错误。
[答案] B
3.(2016.荆州模拟)下列叙述正确的是( )
A.NH3是极性分子,N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央
[解析] A.NH3是极性分子,N原子处在三角锥形的顶点,3个H原子处于锥底,错误。B.CCl4是非极性分子,四个Cl原子构成的是正四面体结构,C原子处在4个Cl原子所组成的四面体的中心,错误。C.H2O是极性分子,是V形分子,O原子不处在2个H原子所连成的直线的中央,正确。D.CO2是非极性分子,三个原子在一条直线上,C原子处在2个O原子所连成的直线的中央,错误。
[答案] C
4.配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物[Cu(NH3)4](OH)2的中心离子、配体、中心离子的电荷数和配位数( )
A.Cu2+、NH3、2+、4 B.Cu+、NH3、2+、4
C.Cu2+、OH-、2+、2 D.Cu2+、NH3、2+、2
[解析] 由配合物[Cu(NH3)4](OH)2分析,因外界有两个OH-,故Cu元素显+2价,故中心离子为Cu2+,配体为NH3,配位数为4。
[答案] A
5.(2015.四川卷)X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是______________。
(2)利用价层电子对互斥理论判断TU3的立体构型是______________。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是________(填化学式);Z和U的氢化物中沸点较高的是________(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是________(填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是__________________________________________。
[解析] X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。Z和U位于第ⅦA族,故Z为F元素,U为Cl元素;X和Z可形成化合物XZ4,则X为C元素;X和R属同族元素,则R为Si元素;Q基态原子的s轨道和p轨道的电子总数相等,则Q为Mg元素;T的一种单质在空气中能够自燃,则T为P元素。
(1)R为Si元素,原子序数为14,故其基态原子的电子排布式是1s22s22p63s23p2或[Ne]3s23p2。
(2)TU3为PCl3,根据价层电子对互斥理论,由中心原子P的孤电子对数为1,成键电子对数为3,故PCl3的VSEPR模型为四面体形,立体构型为三角锥形。
(3)与碳同一周期,非金属性由强到弱依次为F、O、N,由于F没有正价,O无最高正价,故X所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;HF、HCl均为分子晶体,但由于HF中存在氢键,所以沸点:HF>HCl;Si为原子晶体,Mg为金属晶体,Cl2为分子晶体,熔点由高到低的顺序为Si、Mg、Cl2。
(4)CuSO4溶液与P4反应可生成P的最高价含氧酸H3PO4和铜,故该反应的化学方程式为10CuSO4+P4+16H2O===4H3PO4+10Cu+10H2SO4。
[答案] (1)1s22s22p63s23p2或[Ne]3s23p2
(2)三角锥形
(3)HNO3 HF Si、Mg、Cl2
(4)10CuSO4+P4+16H2O===4H3PO4+10Cu+10H2SO4
6.(1)H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____________________________________。
(2)H、N、O、S元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(3)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
|
化学键 |
C-C |
C-H |
C-O |
Si-Si |
Si-H |
Si-O |
|
键能(kJ.mol-1) |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是_______________。
(4)在乙醇中的溶解度:S(HCHO)>S(H2S),其原因是_______________。
(5)已知X的最高价氧化物对应的水化物化学式为H2XO3,Y是地壳中含量最高的元素,则XY2由固态变为气态所需克服的微粒间作用力是________,氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称________。
[答案] (1) H2O与CH3CH2OH之间可以形成氢键
(2)HNO2 H2SO3
(3)①C-C键和C-H键的键能较高,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成 ②C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键
(4)HCHO在乙醇中的溶解度大于H2S在乙醇中的溶解度,是因为乙醇分子与HCHO分子之间能形成氢键,而乙醇分子与H2S分子之间不能形成氢键
(5)分子间作用力 乙酸