
1.遵循的原理
2.原子核外电子排布的轨道能量顺序
1s__2s__2p__3s__3p__4s__3d__4p 5s……
1.电子排布式
(1)铝原子的电子排布式为1s22s22p63s23p1或[Ne]3s23p1。
(2)溴原子的电子排布式为1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5。
2.轨道表示式
(1)氧原子的轨道表示式为______。
(2)磷原子的轨道表示式为__ 。
3.外围电子排布式
氯原子的外围电子排布式为3s23p5。
思考交流:
1.根据原子核外电子排布原则分析,为什么原子核外电子的最外层不超过8个,次外层不超过18个?
[提示] 最外层为K层时,电子数最多为2个(1s2);最外层为L层时,电子数最多为8个(2s22p6);最外层为M层时,电子数最多为8个(3s23p6)……类推出最外层电子不超过8个。
最外层为第六电子层时,次外层的电子数最多为18(5s25p65d10),倒数第三层的电子数最多为32(4s24p64d104f14);最外层为第七电子层时,次外层的电子数最多为18(6s26p66d10);倒数第三层的电子数最多为32(5s25p65d105f14)……类推出次外层电子不超过18个,倒数第三层电子不超过32个。
1.基态原子是处于能量最低状态的原子。
2.激发态原子:基态原子吸收能量后,电子从能量较低原子轨道上跃迁到能量较高轨道上成为激发态原子。
3.光谱
不同元素的原子发生跃迁时会吸收(基态→激发态)和放出(激发态→基态)能量,产生不同的光谱——原子光谱(吸收光谱和发射光谱)。光是电子释放能量的重要形式。
思考交流:
2.金属元素的焰色反应是如何形成的?根据形成过程分析焰色反应属于物理变化还是化学变化?
[提示] 金属元素的原子吸收能量后,电子从能量较低的轨道跃迁到能量较高的轨道,但处在能量较高轨道上的电子会很快地以光的形式辐射能量而跃迁回能量较低的轨道,所发出的光形成焰色。焰色反应属于物理变化。
课堂互动探究
[问题导思]
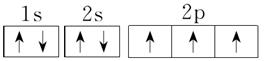
①氮原子的2p轨道上有3个电子,它在3个2p轨道上如何排布?
②钙原子的核外电子排布为什么是2,8,8,2,而不是2,8,10呢?
③所有元素的原子都是按原子核外电子排布原则,填完一个能级,再填下一个能级吗?
[提示]  。
。
②钙原子的电子排布式为1s22s22p63s23p64s2,故M层有8个电子;若M层有10个电子,违背了能量最低原理。
③不是。
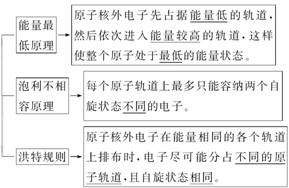
1.能量最低原理
(1)基态原子的核外电子排布使整个原子体系能量最低。
(2)基态原子核外电子在原子轨道上的排布顺序为:1s2s2p3s3p4s3d4p5s……
2.泡利不相容原理
每个原子轨道上最多只能容纳两个电子,而且自旋方向不同(用“↑↓”表示)。
3.洪特规则
(1)原子核外电子在能量相同的各个轨道上排布时,将尽可能分占不同的原子轨道,且自旋方向相同,这样整个原子的能量最低。如2p3的电子排布为 ,不能为
,不能为 或
或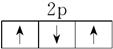 。
。
(2)洪特规则特例:能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定。
温馨提示
1.考纲要求掌握1-36号元素的原子核外电子排布,对应地必须记忆的能级顺序为“1s→2s→2p→3s→3p→4s→3d→4p”。
2.1-36号元素中,应特别关注铬和铜的基态原子核外电子排布式:
例1 下列元素的原子的电子排布式各违背了哪一规律?
(1)6C 1s22s22p
(2)21Sc 1s22s22p63s23p63d3
(3)22Ti 1s22s22p63s23p10
易错警钟

变式训练
1.(2013.新课标高考Ⅰ节选)硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为________________________________________________________________________,
该能层具有的原子轨道数为______________、电子数为__________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
[问题导思]
①电子排布式在书写的时候,是按填充顺序依次写的吗?试说明原因。
②画出26Fe原子结构示意图?
[提示] ①不是。应将电子层数相同的能级按能量由低到高的顺序连在一起;整体上从左到右按电子层数由小到大顺序书写。
②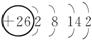 。
。
|
原子结构示意图 |
意义 |
将每个电子层上的电子总数表示在原子核外的式子 |
|
|
实例 |
 |
|
电子排布式 |
意义 |
用数字在轨道符号右上角标明该原子轨道上排布的电子数,这就是电子排布式 |
|
实例 |
K 1s22s22p63s23p64s1 |
|
|
简化电子排布式 |
意义 |
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示 |
|
实例 |
K:[Ar]4s1 |
|
|
外围电子排布式 |
意义 |
主族元素的价层电子指最外层电子,价层电子排布式即外围电子排布式 |
|
实例 |
Al:3s23p1 |
|
|
轨道表示式 |
意义 |
每个方框代表一个原子轨道,每个箭头代表一个电子 |
|
实例 |
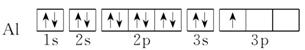 |
温馨提示
画21-36号元素原子结构示意图时,应参考原子核外电子排布式。
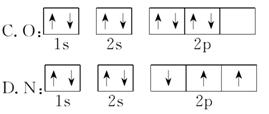
例1 (2013.扬州高二质检)下列表达式正确的是( )
A.铬原子的简化电子排布式为:[Ar]3d44s2
B.S2-的结构示意图为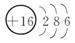
C.N原子的轨道表示式为
D.Fe原子的电子排布式为1s22s22p63s23p63d64s2
规律方法
书写核外电子排布式时应严格按照原子轨道能量由低到高的顺序排布;但原子失电子时,遵循由外到内的顺序。如26Fe核外电子排布时,应先排4s后排3d,但Fe失电子时,先失4s电子再失3d电子。
变式训练
2.某元素A原子的L层要比M层少6个电子,它有两种常见的阳离子a和b(其中a的化合价大于b的化合价)。则:
(1)a的M层比N层多________个电子;b的L层比M层少 ________个电子。a的稳定性________(填“大于”或“小于”)b的稳定性。
(2)写出A的电子排布式:________;a的外围电子轨道表示式为________________。
例 比较下列能级的能量大小关系(填“>”“=”或“<”)
(1)2s________4s (2)3p ________3d
(3)3d________4s (4)4d________5d
(5)2p________3s (6)4d________5f
学习小结

当堂双基达标
1.(2013.徐州高二质检)某原子核外电子排布为ns2np7,它违背了( )
A.泡利不相容原理 B.能量最低原理
C.洪特规则 D.洪特规则特例
2.以下电子排布式不是基态原子的电子排布的是( )
A.1s12s1 B.1s22s1
C.1s22s22p63s2 D.1s22s22p63s1
3.(2013.无锡高二质检)下列各原子的电子排布式或轨道表示式正确的是( )
A.K+:1s22s22p63s23p6
B.Cr:[Ne]3s23p63d44s2
4.下列图像中所发生的现象与电子的跃迁无关的是( )

5.氮原子的下列外围电子轨道表示式中,哪一种状态的能量较低?试说明理由。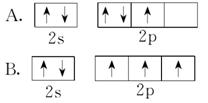
6.(2013.青岛高二质检)以基态硅原子为例,如果电子排布式写作1s22s22p63s13p3,则违反了________原理,如写作1s22s22p63s33p1,则违反了________原理,正确的电子排布式是______,其外围电子排布式是______。
7.按要求填空:
(1)Cu的原子结构示意图为_______________________________________________。
(2)P的外围电子排布式为________________________________________________________。
(3)Fe的电子排布式为_________________________________________________。
(4)N的轨道表示式为_______________________________________________________。
(5)X元素的外围电子排布式是4s24p5,X的元素符号是________。
第2课时 原子核外电子的排布 课 标 解 读 重 点 难 点 1.了解原子核外电子排布所遵循的原理,知道原子轨道能量顺序。 2.能用电子排布式表示1-36号元素原子的核外电子排布。 3.知道原子核外电子在一定条件下会发生跃迁,了解其简单应用。 1.原子核外电子排布所遵循的原理。(重点) 2.用电子排布式表示1-36号元素原子的核外电子排布。(难点) 课前自主导学参考答案
参考答案
一、1.能量低 能量较高 最低 不同 不同的原子轨道 相同
2.< < < < < < <
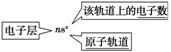
二、1.电子数 原子轨道
2. (1) _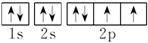 。
。
(2)  。
。
课堂互动探究
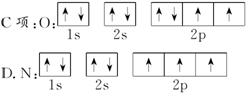
一、 例1 [解析] (1)对于C原子来说,2p有3个能量相同的原子轨道,2p上的2个电子应该以自旋方向相同的方式分布在两个不同的2p轨道上。
(2)根据轨道能量高低顺序可知E4s<E3d,对于21Sc来说,最后3个电子应先排满4s,再排3d,应为
1s22s22p63s23p63d14s2。
(3)对于22Ti来说,3p共有3个轨道,最多可以排6个电子,不能排10个电子。
[答案] (1)洪特规则 (2)能量最低原理
(3)泡利不相容原理
变式训练
1.[解析] (1)Si的原子序数为14,则核外电子数为14,电子排布式为1s22s22p63s23p2,依据核外电子能量排布原理,电子由离核近的区域依次由里向外排布,所以电子占据的最高能层符号为M,该能层具有的原子轨道为s、p、d轨道,共计9个原子轨道,电子数为4。
(2)硅元素在地壳中的含量居第二位,自然界中硅元素主要以硅酸盐和二氧化硅的形式存在,无游离态的硅。
[答案] (1)M 9 4 (2)二氧化硅
二、例1[解析] A项违背洪特规则;B项S2-最外层有8个电子;C项中N原子2p上是3个电子且自旋方向标错。
[答案] D
变式训练
2.[解析] 由题意可知A元素的L层已填满,共有8个电子,可得A的M层上有14个电子,则A的第三层电子排布为3s23p63d6,可得A的核外电子排布式为1s22s22p63s23p63d64s2,即A为Fe原子,其两种阳离子为Fe3+和Fe2+,阳离子a的电子排布式为1s22s22p63s23p63d5,阳离子b的电子排布式为1s22s22p63s23p63d6,再根据洪特规则,a的3d轨道处于半充满状态,a比b稳定。
[答案] (1)13 6 大于 (2)1s22s22p63s23p63d64s2(或[Ar]3d64s2)

例 [解析] 由原子核外电子排布的轨道能量顺序①同一能层的能量高低顺序为:ns<np<nd<nf;②不同能层之间会产生能级交错现象,即能层序数大,其能级的能量不一定高,如3d具有的能量介于4s和4p具有的能量之间。根据原子核外电子排布的轨道能量顺序不难比较各能级能量的大小。
[答案] (1)< (2)< (3)> (4)< (5)< (6)<
当堂双基达标
1.[解析] p有三个原子轨道,据泡利不相容原理,每个轨道最多排布2个电子,故p原子轨道最多排布6个电子,不可能排布7个电子,故违背泡利不相容原理。
[答案] A
2.[解析] 基态原子的电子排布式是能量最低的。A项1s未排满。
[答案] A
3.[解析] B项中Cr:[Ne]3s23p63d54s1
[答案] A
4.[解析] D项平面镜成像是一种物理现象,不存在电子的跃迁;A、B、C三项中物质变化均与原子核外的电子跃迁有关。
[答案] D
5.[解析] 根据洪特规则,电子在能量相同的各个轨道上排布时尽可能分占不同的原子轨道,且自旋状态相同。只有符合核外电子排布原理的状态才是能量最低状态。
[答案] B A中核外电子排布违背了洪特规则。
6.[答案] 能量最低 泡利不相容
1s22s22p63s23p2 3s23p2
7.[解析] Cu的电子排布式是1s22s22p63s23p63d104s1,所以其原子结构示意图是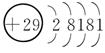 ;P的外围电子排布式为3s23p3;Fe的电子排布式为1s22s22p63s23p63d64s2;N的电子排布式为1s22s22p3,所以其轨道表示式是
;P的外围电子排布式为3s23p3;Fe的电子排布式为1s22s22p63s23p63d64s2;N的电子排布式为1s22s22p3,所以其轨道表示式是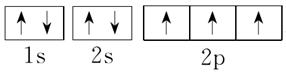 。X元素出现了4p层,说明3d层已经排满,其电子排布式为1s22s22p63s23p63d104s24p5,原子序数是35,为溴元素。
。X元素出现了4p层,说明3d层已经排满,其电子排布式为1s22s22p63s23p63d104s24p5,原子序数是35,为溴元素。
[答案] (1) 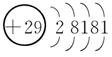
(2)3s23p3 (3)1s22s22p63s23p63d64s2
(4) 
(5)Br