
1、将pH试纸用蒸馏水湿润后,去测定某溶液的pH值,测得该溶液的pH值结果将会( )
A.偏高 B.偏低
C.不变 D.上述三种情况均有可能
2、313 K时,水的Kw=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液( )
A.呈酸性 B.呈中性 C.呈碱性 D.无法判断
3、 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
①a=5时,A是强酸,B是弱酸;
②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强;
④A、B两种酸溶液的物质的量浓度一定相等。
A.①② B.③④ C.①③ D.②④
4、如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是( )
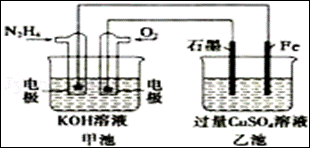
A.甲池中负极上的电极反应式为N2H4﹣4e﹣=N2+4H+
B.乙池中石墨电极上发生的反应为4OH﹣﹣4e﹣=2H2O+O2↑
C.甲池溶液pH增大,乙池溶液pH减小
D.甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体
5、在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
6、将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度 相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A. 9 B.10 C.11 D.12.
7、常温下把1mL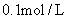 的
的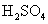 稀释成2 L溶液,下列有关稀溶液的说法不正确的是( )
稀释成2 L溶液,下列有关稀溶液的说法不正确的是( )
A.溶液中的
 为1×
为1×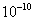

B.溶液中的
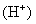 为1×
为1×

C.溶液中由水电离出来的 的浓度为1×
的浓度为1×

D.溶液中由水电离出来的 的浓度为
的浓度为

8、下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol﹣则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨,s)═C(金刚石,s);△H>0则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ/mol,则20.0gNaOH 固体与稀盐酸完全中和,放出28.7kJ的热量
D. 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2
则△H1>△H2
9、实验研究表明,碱性锌一高铁酸钡电池可表现出比碱性锌锰电池更优越的放电功能,其电池反应为:2BaFe04 +3Zn+202==Fe203+Zn0 +2BaZn04 下列说法不正确的是( )
A. Zn棒为负极
B.电池工作时,电子由Zn棒经导线传入BaFe04极
C.该电池每消耗22.4L(标准状况)02,转移的电子数约为2.408×1024个
D. BaFe04与BaZn04中Fe与Zn的化合价相同
10、氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.相同温度下,1 mol/L氢氰酸溶液比1 mol/L盐酸溶液的pH大
B.HCN易挥发
C.10 mL1 mol/LHCN恰好与10 mL 1 mol/L NaOH溶液完全反应
D.HCN溶液的导电性弱
11、如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是( )

A、电源A极是正极
B、(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2:2:2
C、欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D、装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
12、我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是( )

A.a为正极
B.左池电极反应式为C6H6O+11H2O﹣28e﹣=6CO2↑+28H+
C.若右池产生0.672L气体(标况下),则转移电子0.15mol
D.左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5
13、推销净水器的商人用自来水做电解实验,一段时间后两极间产生灰绿色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验,两极上只有气体产生,水中并无沉淀,用以证明自来水很“脏”.人们将自来水送检,却是合格的,下列有关说法,合理的是( )
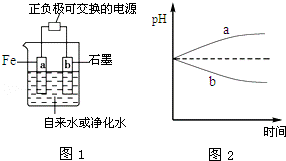
A.商人电解自来水时,用石墨做阳极;电解净化水时,用铁做阳极
B.电解自来水时,阴极反应式:O2+2H2O+4e﹣═4OH﹣
C.电解净化水时,a、b两极的pH变化如图2所示
D.电解自来水实验中,若阴极产生气体为3.36L(标况),则阳极质量减小5.6克
14、用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A. AgNO3 CuCl2 Cu(NO3)2 B. KCl Na2SO4 CuSO4
C. CaCl2 KOH NaNO3 D. HCl HNO3 K2SO4
15、在水中加入等物质的量的Ag+、Ba2+、Na+、SO42-、NO3-、Cl-。该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物和还原产物的质量比为( )
A.35.5∶108 B.16∶137 C.8∶1 D.108∶35.5
16、在25℃时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出m g Na2SO4.10H2O晶体.若温度不变,在剩余溶液中溶质的质量分数为( )
A. ×100%
B.
×100%
B.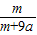 ×100%
C.
×100%
C. ×100%
D.
×100%
D. ×100%
×100%
17、某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应为:

以下说法不正确的是( )
A.放电时负极反应为:Zn-2e–+2OH–=Zn(OH)2
B.放电时正极反应为: +4H2O+3e–=Fe(OH)3+5OH–
+4H2O+3e–=Fe(OH)3+5OH–
C.放电时每转移3 mol电子,正极有1 molK2FeO4被氧化 D.充电时阳极附近溶液的碱性减弱
18、在由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3- 、S2-;②K+、Fe2+、I-、SO42 -;③Na+、Cl-、NO3- 、SO42 -
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-( )
A.①③ B.③⑤ C.③④ D.②⑤
19、含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为Va、Vb,则两者的关系正确的是( )
A.Va>10Vb B.Va=10Vb C.Vb<10Va D.Vb>10Va
20、在25 ℃时,用蒸馏水稀释1 mol.L-1氨水至0.01 mol.L-1,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.c(NH4+)/c(OH-) B.c(OH-)/c(NH3.H2O)
C.c(NH3.H2O)/c(NH4+) D.c(OH-)
21、将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应:
NH4Br(s)  NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)
 Br2(g)+H2(g)
Br2(g)+H2(g)
2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用v(NH3)表示,下列反应速率正确的是( )
A.0.5mol/(L.min) B.2.5 mol/(L.min)
C.2 mol/(L.min) D.5 mol/(L.min)
22、在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是( )
A. B.
B.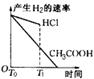 C.
C. D.
D.
第II卷 非选择题(共56分)
23、(5分)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,
 请回答:
请回答:
(1)O点不导电的原因是:__________________________
(2)a、b、c三点的pH由小到大的顺序是______(填a、b或c)。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO---)增大,可以采取下列措施中的_____(填序号)。
A.加热 B.加很稀的NaOH溶液
C.加NaOH固体 D.加水
E.加固体CH3COONa F.加入锌粒
(5)经实验测得C点处:c(CH3COOH)=0.1 mol.L-1,c(CH3COO-)=0.01 mol.L-1,则该条件下CH3COOH的电离常数Ka= 。
24、(7分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(用a,b,c填写)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是____________________
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是________。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为______。反应所需时间的长短关系是____
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
25、(6分)(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为:
7.1× 10-4, 2.98× 10-8。将0.1mol/L的亚硝酸稀释100倍,c(H+)将 (填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”) 。写出HNO2、HClO、NaNO2、 NaClO四种物质之间发生的复分解反应的离子方程式 。
(2)、亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3H+ + H2PO3- 亚磷酸与足量NaOH溶液反应,生成Na2HPO3,写出亚磷酸与少量NaOH溶液反应的
离子方程式
26、(8分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
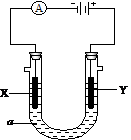 ⑴若X、Y都是惰性电极,a是饱和AgNO3溶液,实验开始时,同时 在两边各滴入几滴石蕊试液,则
⑴若X、Y都是惰性电极,a是饱和AgNO3溶液,实验开始时,同时 在两边各滴入几滴石蕊试液,则
①电解池中X极上的电极反应式是 。
在Y极附近观察到的现象是 。
②Y电极上发生的反应属于 反应。
⑵如要用电解方法实现将铁片镀上一层金属铜,电解液a选用CuSO4溶液,则
①X电极的材料是
②Y电极反应式是 。
③已知开始时铁片与铜片的质量相同,当电路中有0.4摩尔电子通过时,两极质量相差 克
27、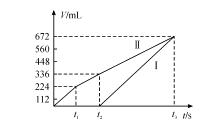 (8分)常温下用惰性电极电解200 mLNaCl 、CuSO4 的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
(8分)常温下用惰性电极电解200 mLNaCl 、CuSO4 的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
(1)曲线 ( 填Ⅰ或Ⅱ)表示阳极产生气体的变化;
(2)NaCl的物质的量浓度为 ,
CuSO4 的物质的量浓度
(3)t2 时所得溶液的pH为 。
28、(5分)
某温度(t℃)时,测得0.01 mol.L-1的NaOH溶液的pH为11,则该温度下水的
KW=________。则该温度________(选填“大于”、“小于”或“等于”)25℃,
其理由是__________________________。
通榆一中2015-2016学年度高二上学期第一次月考 高二化学试卷 考试时间:90分钟 试卷分数:100分 可能用到的相对原子量:Ag-108 Cu- 64 Cl-35.5 Zn-65 S-32 Na--23 N-14 Fe-56 C-12 H-1 O-16,Mg-24, 第I卷 选择题(共44分)参考答案
参考答案
1、[答案]D
2、[答案]C
3、[答案]A
4、[答案]B
5、[答案]B
6、[答案]C
7、[答案]D
8、[答案]B
9、[答案]C
10、[答案]A
11、[答案]C
12、[答案]B
13、[答案]C
14、[答案]B
15、[答案]C
16、[答案]D
17、[答案]C
18、[答案]B
19、[答案]D
20、[答案]B
21、[答案]B
22、[答案]C
23、(10分,每空2分)(1)无自由移动的离子
(2)b<a<c;
(3)C;
(4)ACEF;
(5)1.0×10-3.
24、(7分,每空1分)(1)b>a>c (2)b>a=c;(3)c >a> b(4) c >a= b
(5) a = b =c ; c< a =b (6) c >a= b
25、 (1)(4分)减小(1分)不变(1分)
HNO2+ClO2-=NO2- + HClO(2分)
(2) H3PO3+OH-=H2PO3-+H2O(2分)
26、(8分)(1)①Ag++e+=Ag,(2分)放出气体溶液变红; (1分)②氧化(1分)
(2)①铁(Fe)(1分) ②Cu-2e-=Cu2+(1分) ③25.6g(2分)
27、(8分,每空2分)(1)II(2)0.1mol/L, 0.1mol/L,(3)1
28(5分)(1)1.0×10-13 ,(2分) 大于(1分)理由是:水的电离是吸热的,升温时水的电离平衡正向移动,kW增大,因为该温度下的kW大于250C时水的kW=1.0×10-14,所以该温度大于250C.
29、(12分)(1)①E→C→B→A→D→G→F或E→C→B→D→A→G→F(2分)
②酚酞(1分)
③滴入最后一滴NaOH溶液后,溶液突然变成红色,半分钟不褪色
(2)偏大(2分)(3)乙(1分)(4)偏小(2分) (5)4.20(2分)