
6、Fe3+、SO42-、Al3+和X四种离子以物质的量之比2∶4∶1∶1大量共存于同一溶液中,X可能是
A.Cl- B.OH- C.CO32- D.Na+
7、类推是化学学习和研究中常用的思维方法。下列类推正确的是
A.CO2与SiO2化学式相似,故CO2与SiO2的晶体结构也相似
B.晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
C.检验溴乙烷中的溴原子可以先加氢氧化钠水溶液再加热,充分反应后加硝酸酸化,再加硝酸银,观察是否有淡黄色沉淀,则检验四氯化碳中的氯原子也可以用该方法,观察是否产生白色沉淀
D.向饱和碳酸氢钠溶液中加入氯化铵会有碳酸氢钠晶体析出,则向饱和碳酸氢钾溶液中加入氯化铵也会有碳酸氢钾晶体析出
8、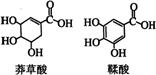 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。有关说法正确的是
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。有关说法正确的是
A.等浓度的两种酸其酸性相同
B.两种酸都能与溴水发生加成反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.鞣酸能与Fe3+发生显色反应,而莽草酸不能
9、用酸性KMnO4溶液进行下列实验,不能达到预期目的的是
A.鉴别苯和甲苯 B.检验硫酸铁溶液中是否有硫酸亚铁
C.检验CH2=CHCHO中含碳碳双键 D.鉴别SO2和CO2
10、PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+。取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液。下列说法错误的是
A.上述实验中不能用盐酸代替硫酸
B.将试管充分振荡后静置,溶液颜色变为紫色
C.在酸性条件下,PbO2的氧化性比MnO4-的氧化性强
D.若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol
11、利用右图装置探究铁在海水中的电化学防护,下列说法错误的是
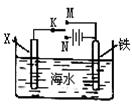 A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e –→ Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H+ + 2e –→ H2↑
12、下列关于工业生产过程的叙述正确的是
A.联合制碱法中循环使用CO2和NH3,以提高原料利用率
B.硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率
C.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
D.炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化成气体或炉渣除去
13、 石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见右图。有关说法错误的是
石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见右图。有关说法错误的是
A.晶体中碳原子键全部是碳碳单键
B.石墨烯与金刚石都是碳的同素异形体
C.石墨烯中所有碳原子可以处于同一个平面
D.从石墨中剥离得到石墨烯需克服分子间作用力
14、某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
15、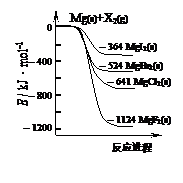 右图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
右图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:
MgBr2(s)+Cl2(g)→MgCl2(s)+Br2(g)+117kJ
16、同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是
A.2KMnO4 +5H2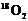 +3H2SO4 →K2SO4+2MnSO4
+5
+3H2SO4 →K2SO4+2MnSO4
+5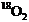 ↑+8H2O
↑+8H2O
 B.NH4Cl+
B.NH4Cl+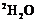 NH3•
NH3•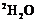 +HCl
+HCl
C.K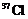 O3+6HCl→K
O3+6HCl→K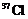 +3Cl2↑+3H2O
+3Cl2↑+3H2O
D.2Na2O2+2H2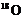 → 4NaOH+
→ 4NaOH+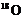 2
2
17、下表是四种盐在不同温度下的溶解度(g/100g水):
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
用物质的量之比为1∶1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如下图所示

以下说法错误的是
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好
选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分)
18、以下各组物质的溶液,不管如何滴加,反应都能用同一离子方程式表示的是
A.FeCl3与Na2S B.Ca(HCO3)2与Ca(OH)2
C.HCl与NaHCO3 D.AgNO3与NH3•H2O
19、在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c (CO2)与温度T的关系如图所示。下列说法错误的是
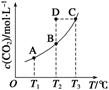 A.反应CO(g)+H2O(g)
CO2(g)+H2(g)为吸热反应
A.反应CO(g)+H2O(g)
CO2(g)+H2(g)为吸热反应
B.在T2时,若反应处于状态D,则一定有v正>v逆
C.平衡状态A与C相比,平衡状态A的c(CO)大
D.若T1、T2时的平衡常数分别为K1、K2,则K1>K2
20、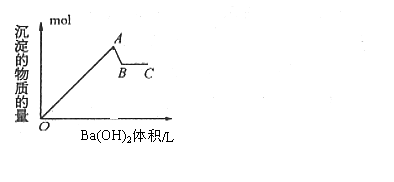 如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是:
如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是:
A.OA段的反应离子方程式为:
2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓
B.AB段的离子方程式只有:Al(OH)3+OH-→AlO2-+2H2O
C.A点的沉淀为Al(OH)3和BaSO4的混合物
D.B点溶液为KAlO2溶液
21、25oC时,用2a mol.L-1NaOH溶液滴定1.0L2a mol.L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如下图所示。下列说法正确的是
A.pH=3时,溶液中:c(Na+)<c(F一)
 B.c(F一)>c(HF)时,溶液一定呈碱性
B.c(F一)>c(HF)时,溶液一定呈碱性
C.pH=3.45时,NaOH溶液恰好与HF完全反应
D.pH=4时,溶液中:
c(HF)+c(Na+)+c(H+)-c(OH-)<2amol.L-1
22、现有1950 g发烟硫酸(用a SO3.H2O 表示),SO3和H2SO4的质量分数分别为0.2和
0.8,加b g水稀释成某浓度的硫酸(用H2SO4.1/9 H2O 表示),则以下正确的是(允许最
后一位数字不同)
A.a=1.38 B. a=1.31 C.b=174 D.b=129
第Ⅱ卷 (共84分)
能源、材料已成为当今科学研究的热点。请回答下列问题:
23、单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1-4个
电子所需能量(电离能)如表所示。若该原子核外电子有三层,则该元素位于周期表 族,写出A燃烧后形成的氧化物的电子式: 。
|
|
I1 |
I2 |
I3 |
I4 |
… |
|
电离能(kJ/mol) |
738 |
1451 |
7733 |
10540 |
… |
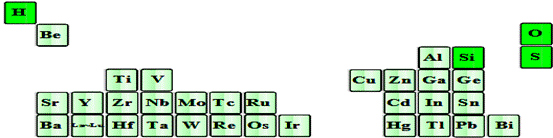
24、上图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是______(填元素符号),其原子最外层有 种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式: 。
25、上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为 ,该物质为________分子(选填“极性”或“非极性”)。
26、铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol
该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式: 。
27、取适量AlMg合金样品置于烧杯中,加入20mL 1 mol/L的NaOH溶液,恰好完全反
应。下列叙述正确的是______(选填编号)。
a.Mg作负极,Al作正极
b.若加入的是20mL
1 mol/L的盐酸,则放出的氢气的物质的量减少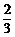
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为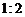
SO2是造成空气污染的主要原因之一,利用钠碱循环法可除去SO2。
28、钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是 。
29、已知常温下,H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以大量共存的是 (选填编号)。
a.CO32- HSO3- b.HCO3- HSO3-
c.SO32- HCO3- d.H2SO3 HCO3-
30、已知NaHSO3溶液显酸性,解释原因____________________________,在NaHSO3稀溶液中各离子浓度从大到小排列顺序是_______________________________________。
31、实验发现把亚硫酸氢钠溶液放置在空气中一段时间,会被空气中的氧气氧化,写出该反应的离子方程式 。
32、在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为_________(填化学式)。
33、如果用含等物质的量溶质的下列溶液分别吸收SO2,则理论吸收量由多到少的顺序是 ____________(用编号排序)。
a.Na2SO3 b. Na2S c.酸性KMnO4
1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
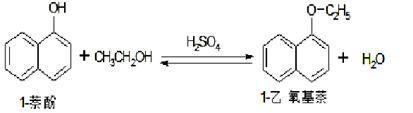
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
|
物质 |
相对分 子质量 |
状态 |
熔点(℃) |
沸点(℃) |
溶解度 |
|
|
水 |
乙醇 |
|||||
|
1-萘酚 |
144 |
无色或黄色菱形结晶或粉末 |
96℃ |
278℃ |
微溶于水 |
易溶于乙醇 |
|
1-乙氧基萘 |
172 |
无色液体 |
5.5℃ |
267℃ |
不溶于水 |
易溶于乙醇 |
|
乙醇 |
46 |
无色液体 |
-114.1℃ |
78.5℃ |
任意比混溶 |
|
34、 将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是
。
将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是
。
35、装置中长玻璃管的作用是: 。
36、该反应能否用实验室制备乙酸乙酯的装置 (选填“能”或“不能”),简述理由 。
37、 反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是
(选填编号)。
反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是
(选填编号)。
a.③②④① b.①②③④ c.②①③④
38、实验测得1-乙氧基萘的产量与反应时间、温度的变化
如图所示,时间延长、温度升高,1-乙氧基萘的产量下降
可能的两个原因是 。
39、提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为 。
高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4.H2O)的流程如下:
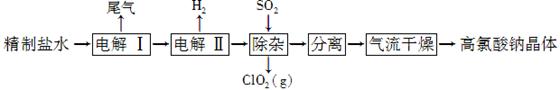
40、由粗盐(含Ca2+、Mg2+、SO、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是____________。
41、电解Ⅰ的目的是制备NaClO3溶液,产生的尾气除H2外,还含有________(填化学式)。电解Ⅱ的化学方程式为_______________________________________________________。
42、除杂目的是除去少量的NaClO3杂质,该反应的离子方程式为__________________。
气流干燥时,温度控制在80-100 ℃的原因是___________________________________。
某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量小于150,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
43、A的分子式是 。
44、若A能与NaHCO3溶液反应放出CO2气体,其结构可能有 种。
45、若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,则A的结构简式是 。
46、若A与NaOH溶液在加热时才能较快反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有 种,其中不能发生银镜反应的物质的结构简式是 。写出该物质与氢氧化钠反应的化学方程式 。
贝诺酯临床主要用于治疗类风湿性关节炎、感冒发烧等。合成路线如下:

47、贝诺酯的分子式 。
48、A→B的反应类型是 ;G+H→I的反应类型是 。
49、写出化合物C、G的结构简式:C ,G 。
50、写出满足下列条件的F同分异构体的结构简式(任写3种) 。
a.不能与FeCl3溶液发生显色反应;
b.能发生银镜反应和水解反应;
c.能与金属钠反应放出H2;
 d.苯环上的一氯取代产物只有两种结构
d.苯环上的一氯取代产物只有两种结构
51、根据题给信息,设计从A和乙酸出发合成 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)。
 示例:
示例:
磷及部分重要化合物的相互转化如图所示。
52、不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
53、步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
|
成分 |
CaO |
P2O5 |
SO3 |
CO2 |
|
质量分数(%) |
47.30 |
28.40 |
3.50 |
6.10 |
54、磷灰石中,碳元素的质量分数为___________%(保留两位小数)。
55、取100 g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4_________________g(保留两位小数)。
56、取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1 mol/L)与其反应,结果Ca、S、P元素全部以CaSO4 和Ca(H2PO4)2 的形式存在,求m的值。
金山区2015学年第一学期期末考试 高三化学试卷 相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 P-31 Ca-40 第Ⅰ卷 (共66分) 1、在化学的发展史上,许多科学家创建的理论对化学科学的发展起到重大的作用。有关科学家与其创建的理论对应不匹配的是 A.墨子:物质的分割是有条件的 B.汤姆生:葡萄干面包模型 C.德谟克利特:古典原子论 D.贝克勒尔:原子结构的行星模型 2、有关碳元素及其化合物的化学用语正确的是 A.CO2的电子式: 参考答案
金山区高三化学第一学期期末考试化学参考答案
一、选择题:(本题共10分,每小题2分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
D |
D |
C |
C |
B |
二、选择题:(本题共36分,每小题3分,)
|
题号 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
答案 |
A |
C |
D |
C |
D |
B |
D |
A |
D |
D |
A |
C |
三、选择题:(本题共20分,每小题4分,)
|
题号 |
18 |
19 |
20 |
21 |
22 |
|
答案 |
BC |
BD |
B |
AD |
BD |
四、填空题(本题共12分)
23、ⅡA
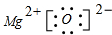
24、Al、3、 H++AlO2-+H2O⇌Al(OH)3⇌ Al3++3OH-(2分)
25、正四面体 、非极性
26、3Fe(s)+4H2O(g) →Fe3O4(s)+4H2+ 150.72kJ (2分)
27、b(2分)
五、填空题(本题共12分)
28、SO32-+SO2+H2O=2HSO3-(2分)
29、b c (2分)
30、亚硫酸氢根的电离程度大于水解程度,Na+>HSO3- >H+ > SO32->OH-
31、 2HSO3-+O2→ 2 SO42-+2H+ (2分)
32、NaI(2分)
33、c=b﹥a (2分)
六、(本题共12分)
34、提高1-萘酚的转化率(2分)
35、冷凝回流
36、不能、产物沸点大大高于反应物乙醇,会降低产率 (2分)
37、a (2分)
38、 1-萘酚被氧化,温度高乙醇大量挥发或温度高发生副反应(2分)
39、50% (2分)
七、(本题共12分)
40、 除去Ca2+和引入的Ba2+(2分) 电解时Br-被氧化(2分)
41、 Cl2(2分) NaClO3+H2ONaClO4+H2↑(2分)
42、 2ClO+SO2→2ClO2+SO(2分)
温度太高,高氯酸钠晶体失去结晶水或分解;温度太低,干燥不充分(2分)
八、(本题共10分)
43、 C8H8O2 (2分)
44、4 (2分)
45、 C6H5COOCH3
46、4(2分)、 CH3COOC6H5
CH3COOC6H5+2NaOH→CH3COONa+C6H5ONa+H2O (2分)
九、(本题共12分)
47、C17H15NO5
48、还原反应;取代反应
 49、
49、
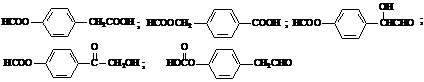 50、
50、
(共3分)
51、
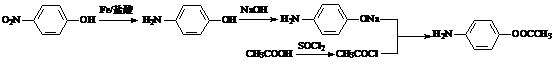
每步反应完全正确得1分,(包括物质与条件)共4分,其他合理答案酌情给分
十、(本题共14分)
52、0.05mol;(2分)
53、Ca (H2PO4)2、CaHPO4;(2分)
54、1.66%;(2分)
55、114.87 g;(2分)
56、2.91 g;(6分)