
1.(2016湖北天门中学月考)将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克 服相同类型作用力的物质有( )
服相同类型作用力的物质有( )
A.2种 B.3种 C.4种 D.5种
2.(2016江苏徐州模拟)N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为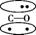 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
A.N2分子与CO分子中都含有三键
B.CO分子中有一个π键是配位键
C.N2与CO互为等电子体
D.N2与CO的化学性质相同
3.(2015安徽理综,7,6分)碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图。下列有关该物质的说法正确的是( )

A.分子式为C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6 g该物质完全燃烧得到6.72 L CO2
4.(2015湖北武汉调研,13)下列有关粒子间的作用力,说法正确的是( )
A.HCl溶于水时H—Cl键会断裂
B.H2O2分子中只有极性键
C.NH3是以非极性键结合的分子
D.MgCl2中既有离子键,又有共价键
5.(2015黑龙江哈尔滨质检)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配 离子[Cu(NH3)4]2+
离子[Cu(NH3)4]2+
C.配位化合物中只有配位键
D.在[Cu(NH3)4]2+中,Cu2+给出孤对电子,NH3提供空轨道
6.(2015河南郑州质量预测)硼酸(H3BO3)是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
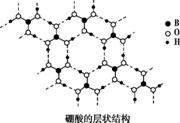
(1)硼酸中B原子的杂化轨道类型为 。
(2)硼酸晶体中存在的作用力有范德华力和 。
(3)加热时,硼酸的溶解度增大,主要原因是 。
(4)硼酸是一元弱酸,在水中电离时,硼酸结合水电离出的OH- 而呈酸性。写出硼酸的电离 方程式: 。
方程式: 。
(5)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,[BH4]-的空间构型是 。
7.(2015陕西渭南二模)锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3.H2O Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式: ,上述方程式中涉及的N、O元素第一电离能由小到大的顺序为 。
(2)P的空间构型是  。
。
(3)与NH3互为等电子体的分子、离子有 、 (各举一例)。
(4)氨基乙酸铜的分子结构如图所示,碳原子的杂化方式为 。

B组 提升题组
8.(2015浙江宁波月考)下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变 小
小
C.CH4的沸点低于SiH4
D.HF、HCl、HBr、HI的热稳定性依次减弱
9.(2015四川成都联考)已知HClO的结构式为H—O—Cl,下列有关说法正确的是( )
A.氧原子采取sp杂化
B.该分子为V形分子
C.氧原子与H、Cl都形成π键
D.该分子的电子式为H∶O∶Cl
10.(2015四川大竹检测)氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2 2HCl +2COCl2,光气的结构
2HCl +2COCl2,光气的结构 式为
式为 。下列说法不正确的是( )
。下列说法不正确的是( )
A.CHCl3分子的空间构型为正四面体
B.COCl2分子中C原子采用sp2杂化
C.COCl2分子中所有原子的最外层都满足8电子稳定结构
D.使用前可用硝酸银稀溶液检验氯仿是否变质
11.(2015课标Ⅱ,37,15分)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为 ;晶胞中A原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

12.(2015山东潍坊二模,33)氢、碳、氮都是重要的 非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是 (填序号)。
a.N3- b.Fe3+ c.Cu d.Cr e.C
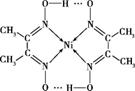
(2)含氮配合物W的结构如图所示(配位键未标出方向),请在结构图中用“→”标出W中所有配位键的方向。

(3)C、H元素形成的某有机化合物分子中共有16个电子,该分子中σ键与π键的个数比为 ;该有机化合物在一定条件下形成的聚合物中C原子采取 杂化。
13.(2015河南三门峡二模)Cu3N具有良好的电学和光学性能,在电子工业、航空航天、国防、通讯以及光学工程等领域中,发挥着广泛的、不可替代的作用。
(1) C、N、O三种元素的第一电离能由大到小的顺序为 。
(2)与N3-含有相同电子数的三原子分子的空间构型是 。
(3)Cu+的电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成 Cu2+和Cu。但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成 Cu2O: 。
Cu2+和Cu。但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成 Cu2O: 。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是 ,乙醛分子中H—C键与C O键的键角 (填“大于”“等于”或“小于”)乙醇分子中H—C键与C—O键的键角。
O键的键角 (填“大于”“等于”或“小于”)乙醇分子中H—C键与C—O键的键角。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。
答案全解全析
A组 基础题组
1.C Na为金属晶体,熔化时克服金属键;Na2 O、NaOH、Na2S、Na2SO4为离子晶体,熔化时克服离子键。
O、NaOH、Na2S、Na2SO4为离子晶体,熔化时克服离子键。
2.D N2化学性质相对稳定,CO具有比较强的还原性,两者化学性质不同。
3.A A项正确;一个碳酸亚乙烯酯分子中含有8个σ键,B项不正确;碳酸亚乙烯酯分子中有碳碳非极性键,C项不正确;没有说明是在标准状况下,D项不正确。
4.A B项,H2O2分子中两个氧原子之间为非极性键,错误;C项,NH3中N和H之间为极性键,错误;D项,MgCl2中只有离子键,错误。
5.B 发生的反应为Cu2++2NH3.H2O Cu(OH)2↓+2N,Cu(OH)2+4NH3
Cu(OH)2↓+2N,Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-,[Cu(NH3)4]2+是深蓝色的,A项错误,B项正确;配位化合物中一定含有配位键,但也含有其他化学键,C项错误;Cu2+提供空轨道,而NH3提供孤对电子,D项错误。
[Cu(NH3)4]2++2OH-,[Cu(NH3)4]2+是深蓝色的,A项错误,B项正确;配位化合物中一定含有配位键,但也含有其他化学键,C项错误;Cu2+提供空轨道,而NH3提供孤对电子,D项错误。
6. 答案 (1)sp2
答案 (1)sp2
(2)氢键、共价键
(3)加热破坏了硼酸分子之间的氢键
(4)H3BO3+H2O
 [B(OH)4]-+
H+
[B(OH)4]-+
H+
(5)正四面 体
体
 解析 硼酸(H3BO3)是平面结构,中心原子采取sp2杂化。硼酸中,B和O、O和H之间是依靠共价键结合在一起的,而硼酸分子之间除了范德华力还有氢键的存在。加热时,硼酸的溶解度增大,主要是破坏了硼酸分子之间的氢键;[BH4]-和N相似,所以其空间构型应该是正四面体。
解析 硼酸(H3BO3)是平面结构,中心原子采取sp2杂化。硼酸中,B和O、O和H之间是依靠共价键结合在一起的,而硼酸分子之间除了范德华力还有氢键的存在。加热时,硼酸的溶解度增大,主要是破坏了硼酸分子之间的氢键;[BH4]-和N相似,所以其空间构型应该是正四面体。
7. 答案 (1)3d9 O<N
答案 (1)3d9 O<N
(2)正四面体
(3)PH3 或AsH3 H3O+或C
(4)sp3、sp2
 解析 (1)铜是29号元素,Cu2+核外电子排布式为3d9;(2)P中P原子的价层电子对数为4,且不含孤电子对,所以其空间构型为正四面体;(3)与NH3互为等电子体的分子和离子分别为:PH3 或AsH3、H3O+或C。
解析 (1)铜是29号元素,Cu2+核外电子排布式为3d9;(2)P中P原子的价层电子对数为4,且不含孤电子对,所以其空间构型为正四面体;(3)与NH3互为等电子体的分子和离子分别为:PH3 或AsH3、H3O+或C。
B组 提升题组
8.B A项中水加热时难以分解,说明水分子内氢原子和氧原子之间的共价键较强;B项与水分子间的氢键有关,液态水结成冰时,由于氢键的作用,水分子有规律地排列形成晶体,使水分子之间的空隙增大,体积变大,密度变小;C项与分子间作用力大小有关;D项中,虽然低温下HF分子之间存在氢键,但热稳定性与分子之间的氢键无关,HF、HCl、HBr、HI的热稳定性只与卤素原子和氢原子之间的共价键强弱有关。
9.B HClO中O原子形成2个σ键,孤电子对个 数为2,价层电子对
数为2,价层电子对 数为4,为sp3杂化,空间构型为V形,故A项错误,B项正确;从次氯酸的结构式可以看出含有O—H、O—Cl,共价单键为σ键,故C项错误;该分子的电子式为H∶∶,
数为4,为sp3杂化,空间构型为V形,故A项错误,B项正确;从次氯酸的结构式可以看出含有O—H、O—Cl,共价单键为σ键,故C项错误;该分子的电子式为H∶∶, 故D项错误。
故D项错误。
10.A CHCl3分子的4个共价键不完全相同,所以不是正四面体,A项错误;COCl2分子的结构式为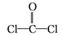 ,C原子有3个价层电子对,孤电子对数为0,为sp2杂化,B项正确;COCl2的电子式为
,C原子有3个价层电子对,孤电子对数为0,为sp2杂化,B项正确;COCl2的电子式为
∶∶,C项正确;氯仿变质,有氯化氢生成,加入硝酸银稀溶液有白色沉淀生成,所以使用前可用硝酸银稀溶液检验氯仿是否变质,D项正确。
11. 答案 (1)O 1s22s22p63s23p3(或[Ne]3s23p3)
答案 (1)O 1s22s22p63s23p3(或[Ne]3s23p3)
(2)O3 O3相对分子质量较大,范德华力大 分子晶体
离子晶体
(3)三角锥形 sp3
(4)V形 4
2Cl2+2Na2CO3+H2O Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3
Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3 Cl2O+CO2+2NaCl)
Cl2O+CO2+2NaCl)
(5)Na2O 8 =2.27 g.cm-3
 解析 由题意可知A为O、B为Na、C为P、D为Cl。(1)四种元素中O的非金属性最强,电负性最大;P的原子序数为15,核外电子排布式为1s22s22p63s23p3或[Ne]3s23p3。(2)氧元素的两种同素异形体为O2和O3,沸点较高的是O3
解析 由题意可知A为O、B为Na、C为P、D为Cl。(1)四种元素中O的非金属性最强,电负性最大;P的原子序数为15,核外电子排布式为1s22s22p63s23p3或[Ne]3s23p3。(2)氧元素的两种同素异形体为O2和O3,沸点较高的是O3 ,因为O3的相对分子质量较大,范德华力大。O的氢化物可以是H2O、H2O2,二者所属晶体类型均为分子晶体;Na的氢化物为NaH,属于离子晶体。(3)PCl3中中心原子的价层电子对数是4,其中σ键数是3,孤电子对数为1,故PCl3中中心原子采用sp3杂化方式,分子构型为三角锥形。(4)Cl2O中中心原子为O,分子中σ键数为2,中心原子孤电子对数为2,故中心原子的价层电子对数为4,分子空间构型为V形。Cl2与湿润的Na2CO3反应生成Cl2O的同时还应该生成NaCl和 NaHCO3。(5)由晶胞结构可知,一个晶胞中小球个数为8,大球个数为4,小球代表离子半径较小的Na+,大球代表离子半径较大的O2-,故F的化学式为Na2O;晶胞中与每个氧原子距离最近且相等的钠原子有8个;晶胞的质量为×4,晶胞的体积为(0.566
,因为O3的相对分子质量较大,范德华力大。O的氢化物可以是H2O、H2O2,二者所属晶体类型均为分子晶体;Na的氢化物为NaH,属于离子晶体。(3)PCl3中中心原子的价层电子对数是4,其中σ键数是3,孤电子对数为1,故PCl3中中心原子采用sp3杂化方式,分子构型为三角锥形。(4)Cl2O中中心原子为O,分子中σ键数为2,中心原子孤电子对数为2,故中心原子的价层电子对数为4,分子空间构型为V形。Cl2与湿润的Na2CO3反应生成Cl2O的同时还应该生成NaCl和 NaHCO3。(5)由晶胞结构可知,一个晶胞中小球个数为8,大球个数为4,小球代表离子半径较小的Na+,大球代表离子半径较大的O2-,故F的化学式为Na2O;晶胞中与每个氧原子距离最近且相等的钠原子有8个;晶胞的质量为×4,晶胞的体积为(0.566 ×10-7)3 cm3,晶体密度为=2.27 g.cm-3。
×10-7)3 cm3,晶体密度为=2.27 g.cm-3。
12. 答案 (1)d
答案 (1)d
(2)
(3)5∶1 sp3
 解析 (1)N3-、Fe3+、Cu、Cr、C中未成对电子数分别是0、5、1、6、2,选d。(3)C、H元素形成的某有机化合物分子中共有16个电子,则为乙烯,共价单键为σ键,共价双键中一个是σ键一个是π键,一个该分子中有σ键5个、π键1个,所以二者之比为5∶1;
解析 (1)N3-、Fe3+、Cu、Cr、C中未成对电子数分别是0、5、1、6、2,选d。(3)C、H元素形成的某有机化合物分子中共有16个电子,则为乙烯,共价单键为σ键,共价双键中一个是σ键一个是π键,一个该分子中有σ键5个、π键1个,所以二者之比为5∶1;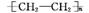 中碳原子杂化方式为sp3杂化。
中碳原子杂化方式为sp3杂化。
13. 答案 (1)N>O>C
答案 (1)N>O>C
(2)V形
(3)1s22s22p63s23p63d10 Cu+3d轨道上电子全充满,其结构稳定
(4)sp3、sp2 大于
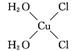
(5)
 解析 (1)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半充满稳定状态,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C;(3)Cu+的核外有28个电子,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时较稳定,Cu+的3d轨道上全满,较稳定;(4)乙醛分子甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,乙醇中碳原子采用sp3杂化,导致乙醛分子中H—C键与C
解析 (1)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半充满稳定状态,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C;(3)Cu+的核外有28个电子,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时较稳定,Cu+的3d轨道上全满,较稳定;(4)乙醛分子甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,乙醇中碳原子采用sp3杂化,导致乙醛分子中H—C键与C O键的键角大于乙醇分子中H—C键与C—O键的键角;(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子的结构式为
O键的键角大于乙醇分子中H—C键与C—O键的键角;(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子的结构式为 。
。