
1.化学与社会可持续发展密切相关。下列做法不合理的是( )
A.出行自带水杯,减少使用一次性纸杯
B.出行自行驾车,践行“绿色出行”
C.推广垃圾的分类回收,研发各种材料再生技术
D.春天办公室不开空调,践行“绿色办公”
2.下列有关化学用语表示正确的是( )
A.质量数为35的氯原子:17 35Cl B.14C的原子结构示意图:
C.N2分子的电子式: D.乙酸乙酯的结构简式为:CH3COOC2H5
D.乙酸乙酯的结构简式为:CH3COOC2H5
3.下列说法正确的是( )
A.结构式为 的物质互为同分异构体
的物质互为同分异构体
B.在加热条件下铜丝能与氯气剧烈反应,所以该反应为吸热反应
C.利用化学方法可以点“石”成“金”,即可以经过化学反应将石墨转变为金刚石
D.相同条件下,等体积的水煤气按a、b两种途径完全转化,途径a比途径b放出更多热能
途径a:CO+H2 CH3OH
CH3OH CO2+H2O
CO2+H2O
途径b:CO+H2 CO2+H2O
CO2+H2O
4.下列对应关系或事实的解释正确的是( )
A.NH4Cl水解呈酸性,不能用来当做肥料使用
B.氧化镁的熔点高,可用于制作耐高温的材料
C.氯碱工业中的“碱”指的是Na2CO3
D.水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料
5.短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,Y原子最外层电子数为电子总数的3/4。下列叙述正确的是( )
A.X和Y、Z和Y组成的化合物中化学键的类型相同
B.原子半径由大到小的顺序:W、Z、Y、X
C.同周期元素中W的最高价氧化物对应水化物的酸性最强
D.简单气态氢化物的稳定性由强到弱的顺序:Y、W
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.PH<7的溶液:Mg2+、K+、SO42-、HCO3-
B.水电离出的c(H+)=10-13 mol.L-1的溶液:Na+、NH4+、CO32-、SO42-
C.0.1 mol.L-1NaAlO2溶液:K+、OH-、Cl-、NO3-
D.通入SO2的饱和溶液:Ca2+、Na+、NO3-、Cl-
7.下列装置可用于NH4Cl固体和Ca(OH)2固体实验室制NH3的实验,能达到实验目的装置的是( )

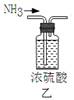


A.用甲做发生装置 B.用乙除去NH3中的杂质
C.用丙来收集NH3 D.用丁进行尾气处理并防止倒吸
8.下列物质的转化在给定条件下能实现的是( )
A.NH3O2催化剂 加热NO2 HNO3
HNO3
B.海水石灰乳Mg(OH)2HCl(aqMgCl2(aq) △ 无水MgCl2
C.Al2O3 HCl(aq AlCl3(aq) NH3.H2O 固体Al(OH)3
D.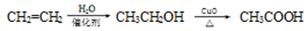
9.下列指定反应的离子方程式正确的是( )
A.用氯化铁溶液腐蚀铜板:Cu+Fe3+===Cu2++Fe2+
B.用洁厕剂(主要成分HCl)清除水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C.用白醋、淀粉碘化钾试纸检验加碘盐是否含碘:5I-+IO3-+6H+=3I2+3H2O
D.向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
10. 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图。下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图。下列有关该电池的说法正确的是( )
A.电池工作时,H+向石墨电极移动
B.氧化银电极上反应为:Ag2O+2e-= 2Ag +O2-
C.石墨电极上反应为:C6H12O6+6H2O-24e-= 6CO2↑+24H+
D.该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况)
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列有关说法正确的是( )
A.一定条件下,使用催化剂能加快反应速率和提高反应物转化率
B.常温下,向水中滴加少量酸形成稀溶液,溶液中c(OH-)和水的离子积常数Kw均不变
C.在锌与足量稀硫酸反应溶液中加入少量铜粉溶液,可以加快反应速率但不影响产生氢气的量
D.在密闭绝热的容器中发生2SO2+O2 2SO3反应,当反应容器温度恒定时,反应达到平衡
2SO3反应,当反应容器温度恒定时,反应达到平衡
12. 槲皮素是苹果多酚中的一种。下列叙述正确的是( )
槲皮素是苹果多酚中的一种。下列叙述正确的是( )
A.槲皮素分子中不含手性碳原子
B.在浓硫酸加热下,槲皮素可发生消去反应
C.槲皮素的苯溶液加入浓溴水产生白色沉淀
D.1mol槲皮素最多可与5molNaOH发生中和反应
13.下列根据实验现象或结论正确是( )
A.浸有NaOH和酚酞的滤纸滴加SO2水溶液,滤纸的红色变浅,说明NaOH还有剩余
B.浸有KMnO4(H+)溶液的滤纸中滴加SO2水溶液,滤纸褪色,说明SO2具有漂白性
C.浸有石蕊溶液的滤纸滴加SO2水溶液,滤纸变红,说明SO2溶于水且反应生成酸
D.浸有品红溶液的滤纸中滴加SO2水溶液,滤纸褪色,再缓慢滴加氯水,滤纸出现红色;若先加氯水再加SO2水溶液现象同上
14.下列有关溶液中微粒浓度关系的叙述正确的是( )
A.向0.1 mol.L-1NH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.溶有等物质的量NaClO、NaHCO3的溶液中:
c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.向CH3COONa溶液中滴加稀HCl至pH=7:c(Cl-)>c(Na+)>c(CH3COOH)
D.等体积等物质的量浓度CH3COOH溶液和CH3COONa溶液混合:
c(CH3COOH)+2c(H+)=2c(OH-)+c(CH3COO-)
15.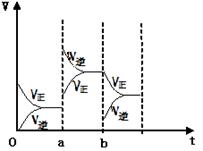 有甲、乙两容器,甲容器的容积固定,乙容器容积可变。在甲、乙容器中分别加入足量的相同的碳粉,再分别加入1molCO2,在相同温度下反应CO2(g)+C(s)
有甲、乙两容器,甲容器的容积固定,乙容器容积可变。在甲、乙容器中分别加入足量的相同的碳粉,再分别加入1molCO2,在相同温度下反应CO2(g)+C(s) 2CO(g)达到平衡。则下列说法正确的是(
)
2CO(g)达到平衡。则下列说法正确的是(
)
A.体系中消耗碳的量n(C):
n(C,甲容器) < n(C,乙容器)
B.逆反应速率 v逆:
v 逆(甲容器)< v 逆(乙容器)
C.CO2转化率α(CO2) :
α(CO2,甲容器) > α(CO2,乙容器)
D.条件改变而引起反应速度和化学平衡的变化情况如图,b 时刻改变的条件可能是移出部分CO
非选择题 (共80分)
16.(12分)钛酸钡是一种强介电化合物材料,是电子陶瓷中使用最广泛的材料之一。以TiCl4溶液和Ba(NO3)2溶液为原料制备钛酸钡粉的流程如下:
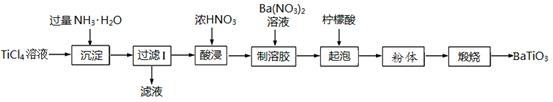
已知在酸性溶液中Ti4+离子水解为TiO2+,中性或弱酸性水解为钛酸(H4TiO4);柠檬酸在150℃分解为CO2和H2O。
(1)过滤Ⅰ得到的滤渣为钛酸(H4TiO4),滤液的主要成分为 ▲ (填化学式);生产过程中若用过量NaOH溶液替代氨水会导致钛元素损失,其原因是 ▲ (用化学方程式表示)。
(2)酸浸时温度与钛的浸取率的关系如图所示:
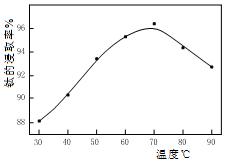
温度高于70℃钛浸取率降低的原因是 ▲ ;写出酸浸时反应的离子方程式 ▲ 。
(3)起泡时温度高于150℃,其目的是 ▲ 。
(4)煅烧时粉体中含有的少量杂质H4TiO4和碳酸钡并不用除去,其原因是(用化学方程式表示) ▲ 。
17.(15分)香草醛是一种重要的香料。可通过以下方法合成:

请回答下列问题:
(1)物质A中的含氧官能团为 ▲ 和 ▲ (填名称)。
(2)化合物B的结构简式为 ▲ 。
(3)由D→E的反应类型是: ▲ 。
(4)香草醛的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应、水解反应,与FeCl3溶液发生显色反应。
Ⅱ.含有5种不同化学环境的氢。
写出该同分异构体的结构简式: ▲ 。
(5)已知:
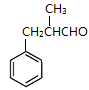 根据已有知识并结合相关信息,写出以苯和
根据已有知识并结合相关信息,写出以苯和 为原料制备有机化合物W(结构简式见右图)的合成路线流程图(无机试剂任用)。
为原料制备有机化合物W(结构简式见右图)的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:

18.(12分)过氧化镁(MgO2)产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。已知过氧化镁与酸反应生成双氧水。
(1)某研究小组通过下列方案测定样品中过氧化镁的含量:取一定量样品,加入足量稀盐酸,充分反应后再加入NaOH溶液调节pH至Mg2+沉淀完全,过滤、洗涤、灼烧,根据固体的质量进行计算。
已知Ksp[Mg(OH)2]=l×10-11。常温下为使Mg2+沉淀完全[使其浓度小于l×10-5mol/L],溶液的pH应调至 ▲ 。
(2)实验室通过下列方案测定样品中过氧化镁的含量:称取0.1000 g样品置于碘量瓶中,加入足量KI溶液和稀硫酸,摇匀后在暗处静置5 min,然后用0.1000 mol/L Na2S2O3的标准溶液滴定至终点 ,消耗溶液Na2S2O3 20.00 mL。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①滴定过程中若操作过慢,导致结果 ▲ (填偏高、偏低或无影响)。
②滴定时选用的指示剂为 ▲ 。
③样品中过氧化镁的质量分数为 ▲ (写计算过程)。
19.(15分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。
(1)装置A中NaClO3和Na2SO3制备ClO2气体,其物质的量的比值为 ▲ ;该装置中采用浓硫酸而不用稀硫酸的原因是 ▲ 。
(2)装置B的作用是 ▲ ;装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是 ▲ 、 ▲ 。
(3)写出装置C发生的离子方程式 ▲ 。
(4)从装置C反应后的溶液获得干燥的NaClO2晶体的操作步骤为:将装置C中的液体取出在减压和55℃条件下蒸发,至出现大量晶体后,_ ▲ (填实验步骤)。
已知:NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。
20.(14分)氯化亚铜是有机合成工业中应用较广的催化剂。
(1)CuCl是不溶于水的白色固体,露置于潮湿空气中很容易被氧化生成碱式盐Cu(OH)Cl,写出其化学反应方程式 ▲ 。
(2)一种用废铜制备氯化亚铜的过程如下:
Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ.mol-1
CuCl2(s) +Cu(s) +4HCl(aq)= 2H2[CuCl3] (aq) △H=+bkJ.mol-1
CuCl(s) + 2HCl(aq)= H2[CuCl3] (aq) △H=-ckJ.mol-1
①反应2Cu(s)+Cl2(g)=2CuCl(s) △H= ▲ kJ.mol-1
②向CuCl2溶液中加入过量铜粉,发生反应生成CuC1。但在实验过程中要加入浓盐酸反应才能持续进行,反应结束后将溶液倒入蒸馏水中稀释获得CuCl。加入浓盐酸的目的是 ▲ 。当c(Cl-)=2×10-3 mol.L-1时,c(Cu+)= ▲ mol.L-1。已知:Ksp(CuCl)=1.7×10-7
(3)目前利用膜电解再生氨性含铜蚀刻废液制备氯化亚铜制备技术获得突破。首先在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释得到氯化亚铜沉淀。
①电解装置如图所示,阴极区电极方程式为 ▲ 。
②稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量变化如图所示。


该工艺得到的产品氯化亚铜含量符合工业要求,从氯化亚铜产率角度分析,最佳稀释温度为 ▲ 。温度越高得到沉淀质量越低,其原因是 ▲ 。
21.(12分)[选做题]本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.[物质结构与性质]
铁与人们的生活息息相关,其单质及其化合物有着广泛的用途。铁与O2、CO等气体反应,也能与硝酸、乙酸等酸性物质反应。请回答下列问题:
(1)Fe2+基态核外电子排布式为 ▲ 。
(2)与CO互为等电子体的阴离子是 ▲ 。
(3)乙酸和尿素(CO(NH2)2)相对分子质量接近,但乙酸熔沸点比尿素高,其原因是 ▲。(4)配合物Fe (CO)5结构式如图:

分子中碳原子的轨道杂化类型是 ▲ ;1mol Fe (CO)5分子中含有σ键的数目为 ▲ 。
(5)某晶胞中Fe2+、Fe3+离子分别占据立方体互不相邻的顶点,CN-位于立方体棱心上,结构如图所示。此晶胞中Fe2+、Fe3+和CN-的个数比为 ▲ 。

B.[实验化学]
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。
合成反应原理为:

已知: 正丁醇沸点 118℃, 纯邻苯二甲酸二丁酯是无色透明、具有芳香气味的油状液体, 沸点 340℃,酸性条件下,温度超过 180℃时易发生分解。实验步骤如下:
步骤1 在三口烧瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器(反应装置如图)。
步骤2 缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3 反应达到终点时,升温至150℃
步骤4 冷却,倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5 减压蒸馏,收集200~210℃、2666Pa馏分,即得DBP产品
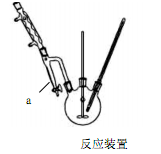 (1)图中仪器分水器作用是 ▲ 。
(1)图中仪器分水器作用是 ▲ 。
(2)步骤3中判断反应达到终点的判断依据是 ▲ 。
(3)步骤3中升温至150℃的目的是 ▲ 。
(4)步骤4中用碳酸钠溶液洗涤的目的是 ▲ ;
碳酸钠溶液浓度不宜过高,其原因是 ▲ 。
(5)步骤5中用减压蒸馏的目的是 ▲ 。