
1.下列说法中正确的是( )
A.放热反应在常温下都能自发进行
B.Fe3+ +3H2O
+3H2O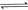 Fe(OH)3+3H+是吸热反应
Fe(OH)3+3H+是吸热反应
C.熵值大小关系为:S(冰)>S(水)>S(水蒸气)
D.对C(s)+H2O(g) 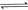 CO(g)+H2(g),多加些炭可以提高化学反应速率
CO(g)+H2(g),多加些炭可以提高化学反应速率
2.下列叙述中正确的是( )
A.稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=﹣57.3kJ/mol
B.在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C.未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境
D.加入催化剂,可以改变化学反应的反应热
3.向纯水中加入少量NaHSO4固体,当温度不变时,则该溶液中( )
A.水电离出的c(H+)减小 B.c(OH-)与c(H-)的乘积增大
C.c(H+)减小 D.c(OH-)增大
4.下列解释事实的反应方程式不正确的是( )
A.Na2S溶液显碱性:S2- + 2H2O 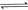 H2S + 2OH-
H2S + 2OH-
B.用排饱和食盐水法收集 :
:


C.草酸溶液使高锰酸钾酸性溶液褪色: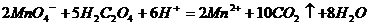
D.向污水中投放明矾,生成能凝聚悬浮物的胶体: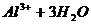
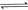

5.若溶液中由水电离产生的C(OH-)=1×10-14 mol.L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ ClO- SO42- NO3-
6.在相同温度时,100mL0.01mol•L-1的氨水溶液与10mL 0.1mol•L-1的氨水溶液相比较,下列数值中,前者大于后者的是( )
A.中和时所需HCl的量 B.NH3.H2O的电离常数
C.OH—的物质的量 D.OH—的浓度
7.用石墨作 电极电解l mol.L-1下
电极电解l mol.L-1下 列物质的水溶液,一段时间后溶液pH不变的是( )
列物质的水溶液,一段时间后溶液pH不变的是( )
①H2SO4 ②NaOH ③KI ④Na2SO4 ⑤CuSO4
A.④ B.①②④ C.③④ D.④⑤
8.下列关于中和滴定的操作错误的是( )
A.滴定前需要检查滴定管是否漏水
B.用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶
C.滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,会使滴定结果偏高
D.用已知浓度盐酸滴定未知浓度的NaOH溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低
9.电瓶车所用的电池一般是铅蓄电池,右图是一种典型的可充电电池,电池总反应式为:
 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-  2PbSO4+2H2O,
2PbSO4+2H2O,
根据上述变化,下列说法中正确的是:( )
A.放电时电极 PbO2 发生氧化反应
B.放电时电子流向由B到A
C.工作时蓄电池里电解质溶液的pH不变
D.充电时阴极反应是PbSO4—2e- +2H2O == PbO2+4H++SO42-
10.下表是五种银盐的溶度积常数(25℃)
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10—10 |
1.4×10—5 |
6.3×10—50 |
7.7×10—13 |
8.51×10—16 |
下列说法错误的是( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.AgCl、AgBr和AgI三种物质在常温下的溶解度依次减小
D.向100mL0.1mol.L—1的Na2SO4溶液中加入1 mL0.1mol.L—1的AgNO3溶液,有白色沉淀生成
11.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.在0.1 mol.L-1NaHCO3溶液中:c(Na+) >c(OH-)>c(HCO3-) >c(H+)>c(CO32-)
B.在0.1 mol.L-1Na2CO3溶液中:c(Na+) + c(H+) = c(OH-) + c(HCO3-) + c(CO32-)
C.一定量(NH4)2SO4与NH3.H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42—)
D.向0.4 mol/L CH3COOK溶液中加入等体积1.2 mol/L HCl溶液:c(CH3COO-) +c(CH3COOH)= 0.4 mol/L
12.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.升高温 度,溶液的pH增大
度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.若要使HA的电离平衡向左移动且溶液的pH值减小,可以在溶液中通入HCl气体
13. 在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入Na Br固体,可使溶液由c点变到b点
Br固体,可使溶液由c点变到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
14.工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g) Si(s)+4HCl(
Si(s)+4HCl( g);△H = +QkJ/mol(Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
g);△H = +QkJ/mol(Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( ) 
A.反应过程中,若减小压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L min)
min)
D.当反应吸收热量为0.5QkJ时,生成的HCl通入1L 1mol/L的NaOH溶液恰好完全反应
15.对可逆反应2SO2(g)+O2(g) 2SO3(g)
ΔH<0,下列图像正确的是( )
2SO3(g)
ΔH<0,下列图像正确的是( )

16. 下列实验装置(部分固定装置略去)和有关叙述正确的是( )
下列实验装置(部分固定装置略去)和有关叙述正确的是( )
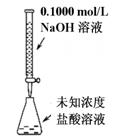
A.可以进行酸碱中和滴定实验 B.可以进行中和热的测定实验
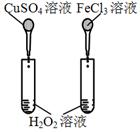

C.可验证温度对化学平衡的影响 D.比较Cu2+、Fe3+对H2O2分解速率的影响
17.(12分)I.计算以下数值(均为25℃时)
(1)某浓度的NH3.H2O溶液中,由水电离的c(H+)=1×10-13mol/L,该溶液的 pH=
(2)PH=11的NaOH溶液稀释100倍,所得溶液的PH=
(3)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
(4)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH
最低为 (已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
II.(1)盐碱地因含较多的 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
。
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
。
(2) 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将 与
与 混合并加热,可得到无水
混合并加热,可得到无水 ,得到无水
,得到无水 的化学方程式为
。
的化学方程式为
。
18.(11分)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和电镀的原理,其中乙装置中X为阳离子交换膜。
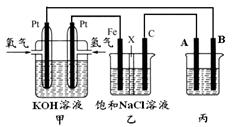
根据要求回答相关问题:
①通入氢气的电极的反应式为 。
②反应一段时间后,在乙装置中滴入酚酞溶液,_
区(填“铁极”或“石墨 极”)的溶液先变红。乙装置中电解反应的总化学方程式_________________________________________。
极”)的溶液先变红。乙装置中电解反应的总化学方程式_________________________________________。
③欲用丙装置给铜镀银。电极A应该是________(填“银”或“铜”),电镀液的主要成分是________(填化学式)。
④若在标准状况下,甲池中有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为 ;丙装置中阴极析出Ag的质量为 。(相对原子质量 Ag:108)
19.(11分)在常温下向20mL 0.1 mol.L-1 某酸( 用HA表示)溶液中逐滴加入0.1 mol.L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
用HA表示)溶液中逐滴加入0.1 mol.L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
|
V(NaOH)mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20 .00 .00 |
20.02 |
20.20 |
22.00 |
40.00 |
|
pH |
3.0 |
4.7 |
5.7 |
6.7 |
7.7 |
8.7 |
 9.7 9.7 |
10.7 |
11.7 |
12.5 |
(1)实验中的指示剂最好使用___________________________;
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种
平衡体系是 、 ;
溶液中离子浓度由大到小的顺序是 ;
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序
是 。
( 4)该温度下, C点对应的体积V=
。
4)该温度下, C点对应的体积V=
。
20.(14分)氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g)  2NO(g)
ΔH = +183 kJ/mol
2NO(g)
ΔH = +183 kJ/mol
2H2(g) + O2(g) === 2H2O(l)
 ΔH = -571.6 kJ/mol
ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) === 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g)  2NH3(g) ΔH = kJ/mol
2NH3(g) ΔH = kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
|
|
N2 |
H2 |
NH3 |
|
投料Ⅰ |
1.0 mol/L |
3.0 mol /L |
0 |
|
投料Ⅱ |
0.5 mo l/L l/L |
1.5 mol/L |
1.0 mol/L |
① 按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K= 。(只需代入数据,不用计算结果)
② 按投料Ⅱ进行反应,起始时反应进行的方向为 (填“正向”或“逆向”)。
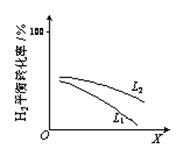 ③ L(L1、L2)、X可代表压强或温度中的一种条件。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
③ L(L1、L2)、X可代表压强或温度中的一种条件。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
ⅰ X代表的物理量是 。
ⅱ 判断L1、L2的大小关系,并简述理由
:
 。
。
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
① 电极b上发生的是 反应(填“氧化”或“还原”)
② 写出电极a的电极反应式: 。

21.(12分) 绿矾(FeSO4 • 7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁
屑(含少量锡等杂质)生产绿矾的一种方法:

已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH
为3.0,沉淀完全时的pH为5.5.
回答下列问题: (1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
② ;
③
 。
(2)操作IV的顺序依次为:
、
、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②
。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL
。
(2)操作IV的顺序依次为:
、
、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②
。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL
容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的
0.02000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为30.00 mL
(滴定时发生反应的离子方程式为:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O). ①计算上述样品中FeSO4 • 7H2O的质量分数为 。(结果保留4位有效数字)
(FeSO4 • 7H2O的摩尔质量为 278g/mol) ②若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差
可忽略),其可能原因有:样品中存在少量的杂质、 。
 |
 |
 |
 |
||||||||||
|
|||||||||||||
 |
|||||||||||||
 |
|
|
|

