
网址:http://www.1010jiajiao.com/paper/timu/193462.html[举报]
11. 养成“规范操作、周密观察”的良好习惯,是完成化学实验的关键。
小华在化学实验技能测试中抽到的题目是:配制100g溶质质量分数为13.5%的碳酸钠溶液并测定其酸碱度。考试时,小华进行了如图所示的操作:
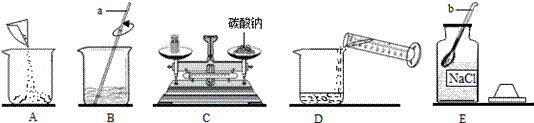
(1)以上实验的正确操作顺序为(用序号字母表示)
(2)上图所示的操作中,若C中砝码的质量为10g,游码的读数为3.5g,则碳酸钠的实际质量为 g,配得溶液的质量分数为 (保留到1%)
该实验中导致配得溶液的质量分数小于13.5%的原因还可能有(写出一个即可)
如果要将100g13.5%的碳酸钠溶液溶质质量分数缩小一倍,可加水 g。
(3)小华在测定所配制溶液的酸碱度时,先将pH试纸用蒸馏水湿润,再进行测定,则测的溶液的pH值 (选填“偏大”、“偏小”或“不受影响”).
(4)为证明酸与碱能发生反应,后来小华还进行了以下实验,请看图回答:
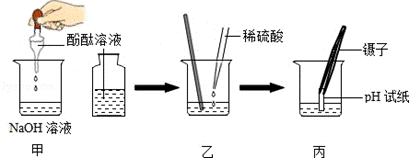
①甲:滴入酚酞试液后,观察到的现象为 ;
②图乙:用滴管慢慢滴入稀硫酸,并不断搅拌至溶液颜色恰好变成红为止,发生反应的方程式可表示为 该反应属于基本反应类型中的
反应该反应的微观过程的实质是
③图丙:丙中操作存在的问题是 ;
若用正确操作测得丙中溶液的pH=5,溶液含有的粒子是(用符号表示)
参考答案
一、 选择题(每小题1分,共10分)
1.B 2.D 3. B 4.C 5.D 6.A 7.C 8.B 9.D 10.D
二、填空与简答题(本大题共5小题,14表格每空0.5,其余每空1分,共44分)
11.(12分)
(1) ECADB
(2)6.5 7% 量水时仰视刻度线(称固体时左盘放纸右盘没放;或天平偏左未调平衡就称量等。) 100
(3)偏小
(4)①酚酞变红 ② 2NaOH+H2SO4=Na2SO4+2H2O 复分解反应 H++OH-=H2O
③将pH试纸直接伸入待测液体中 H+ SO42- Na+
12.(6分)
(1) A=B>C (2)饱和 75 (3)蒸发结晶
(4) 升温(5) B >A> C
13.(8分)
(1)①②
(2)① CaO+H2O =Ca(OH)2 Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2
② 溶解 过滤 蒸发
(3)NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl NaHCO3 △Na2CO3+H2O+CO2↑
14.(11分)
|
序 号 |
① |
② |
③ |
④ |
|
物 质 |
盐酸 |
水 |
熟石灰 |
纯碱 |
|
化学式 (或主要成分的化学式) |
HCl |
H2O |
Ca(OH)2 |
Na2CO3 |
|
微观构成粒子(用符号表示) |
H2O H+ Cl- |
H2O |
Ca2+ OH- |
Na+ CO32- |
(1)② ③ ④
(2) Ca(OH)2+2HCl+=CaCl2+2H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(3)③ (4)③
15.(7分)
(1) 充分溶解 K2CO3 (2)烧杯、玻璃棒 滤纸没有紧贴漏斗内壁,中间留有气泡 (3) HCl、H2O C (4) a
三、实验与探究题(每空1分,共10分)
16. (1)Ca(OH)2
(2) 酚酞 溶液变红 Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
NaOH和Ca(OH)2
(3) 不正确 溶液中的氢氧化钠会与加入的(少量)盐酸反应,即使溶液中有碳酸钠,也可能不产生气体。
(4)Na2CO3 若A中没有沉淀,B中产生白色沉淀
若A、B两支试管中都没有沉淀产生
四、分析与计算(本题6分)
17. 解:设废水中氢氧化钠的质量分数为X
NaOH + HCl = NaCl+H2O
40 36.5
80gX 73g×10%
40:36.5= 80gX: 73g×10%
X=10%
答氢氧化钠溶液质量分数为10%