
网址:http://www.1010jiajiao.com/paper/timu/2563864.html[举报]
8.(14分)铜及其合金是人类最早使用的金属材料。
(1)铜原子的核外电子排布式是________________。
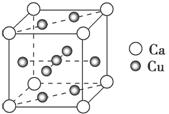
(2)铜的熔点比钙的高,其原因是________________;如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数之比为________。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键 B.金属键
C.极性共价键 D.非极性共价键
E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
解析 (1)铜元素原子的核外电子排布满足“全空、半满、全满稳定”的原理。(2)金属的物理性质主要取决于金属键的强弱,一般金属键越强,金属的硬度越大、熔点越高;该晶胞中顶点的原子按计,面上的原子按计。(3)[Cu(NH3)4]2+中Cu2+和NH3之间形成配位键,NH3内形成极性共价键。[Cu(NH3)4]2+的立体构型可以参照甲烷的立体构型考虑,若为正四面体形,则[Cu(NH3)4]2+中的两个NH3被两个Cl-取代后所得配合物只有一种,若为平面正方形则[Cu(NH3)4]2+中的两个NH3被两个Cl-取代后所得配合物有两种。
答案 (1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)晶体中铜的金属键强度大于钙的 1∶5
(3)①AC ②平面正方形