
网址:http://www.1010jiajiao.com/paper/timu/2563867.html[举报]
11.(15分) (2013.攀枝花模拟)可以由下列反应合成三聚氰胺:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____________________________________________。
CaCN2中阴离子为CN,与CN互为等电子体的分子有N2O和________(填化学式),由此可以推知CN的空间构型为________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________。
 (3)三聚氰胺(
(3)三聚氰胺(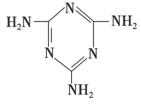 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________。CaO晶体和NaCl晶体的晶格能分别为:CaO 3 401 kJ.mol-1、NaCl 786 kJ.mol-1。导致两者晶格能差异的主要原因是__________________________________________________________________________________________________________________________________________。
解析 (1)Ca的最外层是2个电子,与它同一周期的元素在第四周期,内层排满电子则K到M层分别为2、8、18个电子,则它的基态原子的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;与CN互为等电子体,必须符合原子数相等,价电子总数相等,故可以是CO2,因为CO2是直线形分子,则CN的空间构型是直线形。(2)尿素分子的结构简式为 ,分子中的C原子采用sp2杂化方式,碳氧之间的共价键有1个σ键、1个π键。(3)三聚氰酸与三聚氰胺分子之间通过分子间氢键相互结合而形成结石。(4)由晶胞图可看出,1个Ca2+周围有6个O2-,则晶体中Ca2+的配位数为6;CaO晶体的晶格能远大于NaCl晶体的晶格能的原因是CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。
,分子中的C原子采用sp2杂化方式,碳氧之间的共价键有1个σ键、1个π键。(3)三聚氰酸与三聚氰胺分子之间通过分子间氢键相互结合而形成结石。(4)由晶胞图可看出,1个Ca2+周围有6个O2-,则晶体中Ca2+的配位数为6;CaO晶体的晶格能远大于NaCl晶体的晶格能的原因是CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。
答案 (1)1s22s22p63s23p63d104s2或[Ar]3d104s2 CO2 直线形 (2)sp2  (3)分子间氢键
(3)分子间氢键
(4)6 CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量