
网址:http://www.1010jiajiao.com/paper/timu/2922151.html[举报]
15.(18分)(2013•大庆)现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4,MgCl2,CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
请根据提纯步骤回答下列问题.
(1)步骤⑦的操作名称为 蒸发结晶 .
(2)请写出实验步骤②中所涉及的化学方程式 BaCl2+Na2SO4═BaSO4↓+2NaCl .
(3)步骤⑥中加入过量盐酸的目的是 除去过量的氢氧化钠和碳酸钠 .
(4)步骤②和步骤④ 不可以 (填“可以”或“不可以”)颠倒,理由是 如果颠倒,无法除去过量的氯化钡 .
(5)检验步骤④中Na2CO3溶液已过量的方法是 取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量 .
(6)加碘食盐相关信息如图所示.

食盐中的碘酸钾(KIO3)在酸性条件下,可以将碘化钾(KI)变成碘(I2),化学方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向装有碘化钾和淀粉混合液的试管中,滴入稀盐酸将溶液酸化,再加入食盐,若食盐中有碘化钾,则加入食盐后的实验现象 混合液由无色变成蓝色 .
②小强同学欲测定加碘盐中碘元素的质量分数,实验步骤如下:取10g食盐样品于试管中加水溶解,加入过量KI的和淀粉混合溶液,再滴入稀盐酸将溶液酸化使其充分反应后,调节溶液呈中性,再向试管中滴加硫代硫酸钠溶液(Na2S2O3),发生化学反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI
当加入质量分数为0.237%Na2S2O3溶液2g时,I2恰好反应完全,通过计算判断该食盐样品是否合格(已知Na2S2O3的相对分子质量为158.请写出计算过程).
|
考点: |
氯化钠与粗盐提纯;过滤的原理、方法及其应用;盐的化学性质;根据化学反应方程式的计算;鉴别淀粉、葡萄糖的方法与蛋白质的性质. |
|
专题: |
有关化学方程式的计算;常见的盐 化学肥料. |
|
分析: |
氢氧化钠可以除去氯化镁,氯化钡可以除去硫酸钠,碳酸钠可以除去氯化钙、过量的氯化钡,稀盐酸可以除去过量的氢氧化钠和碳酸钠; 碳酸钠能和氯化钙、氯化钡等物质反应生成沉淀,能和稀盐酸反应生成二氧化碳气体; 通过计算可以判断食盐中的碘元素含量是否合格. |
|
解答: |
解:(1)步骤⑦的操作名称为蒸发结晶. 故填:蒸发结晶. (2)实验步骤②中涉及氯化钡和硫酸钠反应,氯化钡和硫酸钠反应能生成硫酸钡和氯化钠,化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl. 故填:BaCl2+Na2SO4═BaSO4↓+2NaCl. (3)步骤⑥中加入过量盐酸的目的是除去过量的氢氧化钠和碳酸钠. 故填:除去过量的氢氧化钠和碳酸钠. (4)如果颠倒,无法除去过量  的氯化钡. 的氯化钡.故填:不可以;如果颠倒,无法除去过量的氯化钡. (5)检验步骤④中Na2CO3溶液已过量的方法是:取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量. 故填:取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量. (6)由KIO3+5KI+6HCl=6KCI+  3I2+3H2O和2Na2S2O3+I2═Na2S4O6+2NaI可知,I和Na2S2O3的对应关系为:I→6Na2S2O3, 3I2+3H2O和2Na2S2O3+I2═Na2S4O6+2NaI可知,I和Na2S2O3的对应关系为:I→6Na2S2O3,设10g食盐样品中碘元素的质量为X, 2g0.237%的Na2S2O3溶液中Na2S2O3的质量为:2g×0.237%=0.00474g, I→6Na2S2O3, 127 948 X 0.00474g 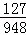 = =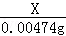 X=0.000635g, 10g食盐样品中碘元素的质量是0.000635g,1000g食盐样品中碘元素的质量为:0.000635g× 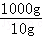 =0.0635g=63.5mg, =0.0635g=63.5mg,与图中的信息比较,该食盐样品不合格. |
|
点评: |
本题主要考查粗盐提纯的过程和根据化学方程式进行计算,计算时一定要认真仔细,避免出错. |