
网址:http://www.1010jiajiao.com/paper/timu/4166003.html[举报]
4.分布系数图及分析[分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线]
|
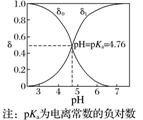
一元弱酸(以CH3COOH为例) |
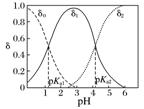
二元酸(以草酸H2C2O4为例) |
 |
 |
|
δ0为CH3COOH分布系数,δ1为CH3COO-分布系数 |
δ0为H2C2O4分布系数、δ1为HC2O分布系数、δ2为C2O分布系数 |
|
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据分布系数可以书写一定pH时所发生反应的离子方程式 |
|
|
同一pH条件下可以存在多种溶质微粒。根据在一定pH的微粒分布系数和酸的分析浓度,就可以计算各成分在该pH时的平衡浓度 |

 例1
例1 已知MOH和ROH均为一元碱,常温下对其水溶液分别加水稀释时,pH变化如图所示。下列说法正确的是( )
已知MOH和ROH均为一元碱,常温下对其水溶液分别加水稀释时,pH变化如图所示。下列说法正确的是( )
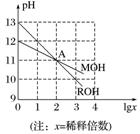
A.在A点时,由H2O电离出的c(H+)相等,c(M+)=c(R+)
B.稀释前,ROH溶液的物质的量浓度等于MOH溶液的物质的量浓度的10倍
C.稀释前的ROH溶液与等体积pH=1的H2SO4溶液混合后所得溶液显酸性
D.等体积、等浓度的MOH溶液和HCl溶液混合后,溶液中离子浓度大小关系为c(Cl-)>c(M+)>c(OH-)>c(H+)
[思路点拨] 本题为电离平衡图像题,需要学生结合选项要求,从图像中提取有用信息进行解答。
|
审题 |
信息提取 |
题目解答 |
|
分析题干信息及四个选项,粗略分析图像信息 |
由图像中两条线段的变化规律,推断出两种碱的强弱(这是解答该题的关键信息) |
确定两条线段的交点(A点)的含义,结合分析出的两种碱的强弱,根据选项内容,确定合理选项 |
解析 由图可知,稀释前ROH溶液的pH=13,稀释100倍时pH=11,故ROH为强碱,而稀释前MOH的pH=12,稀释100倍时pH=11,故MOH为弱碱。由ROH===R++OH-、MOHM++OH-可知,在A点,两种溶液的c(OH-)相等,则c(M+)=c(R+),A项正确;稀释前,ROH溶液的物质的量浓度为0.1 mol.L-1,MOH溶液的物质的量浓度大于0.01 mol.L-1,则ROH溶液的物质的量浓度小于MOH溶液的物质的量浓度的10倍,B项错误;稀释前的ROH溶液与等体积pH=1的H2SO4溶液混合后恰好中和生成盐,溶液显中性,C项错误;MOH为弱碱,等体积、等浓度的MOH溶液与盐酸混合,反应生成强酸弱碱盐,水解显酸性,故c(H+)>c(OH-),D项错误。
答案 A
 例2
例2 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1 mol.L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1 mol.L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
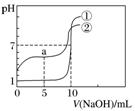
A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化
B.酸溶液的体积均为10 mL
C.a点:c(CH3COOH)>c(CH3COO-)
D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)
[解题思路] 比较图像起点→①代表盐酸且浓度为0.1 mol.L-1→pH=7的点(盐酸与10 mL NaOH完全中和)→盐酸为10 mL,a点醋酸被中和一半,CH3COOH和CH3COONa等物质的量混合,可据此判断。
解析 A项,①代表盐酸,②代表醋酸,正确;B项,向盐酸中加入10 mL NaOH时,pH=7,所以盐酸体积为10 mL,正确;C项,a点是CH3COOH和CH3COONa等物质的量混合,溶液呈酸性,电离大于水解,c(CH3COOH)<c(CH3COO-),错误;D项,符合电荷守恒,正确。
答案 C
 例3
例3 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是( )
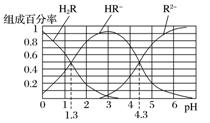
A.在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B.等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
C.在pH=3的溶液中存在=10-3
D.向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO+H2R===2HCO+R2-
[解题思路] 本题考查弱电解质在水溶液中的电离平衡,图像的交点pH→H2R的Ka1、Ka2→判断H2CO3与H2R的强弱;曲线的最高点→HR-、R2-、H2R含量及pH→HR-的电离程度大于水解程度。
解析 A项,在pH=4.3的溶液中,c(HR-)=c(R2-),根据溶液中电荷守恒2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),可知3c(R2-)=c(Na+)+c(H+)-c(OH-),正确;B项,等体积等浓度的NaOH溶液与H2R溶液混合生成NaHR,此时HR-含量最高,H2R和R2-含量接近于0,由题图可知,此时pH接近于3,溶液显酸性,对水的电离起到抑制作用,所以溶液中水的电离程度比纯水小,错误;C项,当溶液pH=1.3时,c(H2R)=c(HR-),则Ka1==10-1.3,当溶液pH=4.3时,c(R2-)=c(HR-),则Ka2==10-4.3,===10-3,正确;D项,由C选项分析可知,H2R的电离常数Ka2大于H2CO3的Ka2,即酸性:HR->HCO,所以向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO+H2R===2HCO+R2-,正确。
答案 B
