
网址:http://www.1010jiajiao.com/paper/timu/4166007.html[举报]
4.(2015.全国卷Ⅰ,13)浓度均为0.10 mol.L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示。下列叙述错误的是( )
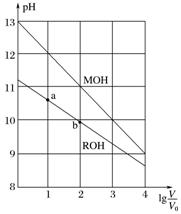
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则增大
答案 D
解析 A项考查根据图像判断电解质的碱性强弱。“起点”隐藏的信息是0.10 mol.L-1的MOH溶液和ROH溶液的pH分别为13和小于13,说明MOH是强电解质即强碱,ROH是弱电解质即弱碱,不符合题意;B项考查弱电解质电离程度的大小比较。稀释过程中隐藏的信息:弱碱的浓度越小电离程度越大,即稀释程度越大电离程度越大;由图中b点的稀释程度大于a点的稀释程度知,b点的电离程度大于a点的,不符合题意;C项考查电解质溶液稀释过程中离子浓度的变化。隐藏的信息:溶液无限稀释后,溶液应接近中性,即c(OH-)相等,不符合题意;D项考查外界因素对电离平衡的影响。升温促进弱电解质电离,而对强电解质电离无影响(因为已经全部电离),即c(M+)不变,c(R+)增大,则减小,符合题意。