
网址:http://www.1010jiajiao.com/paper/timu/4166030.html[举报]
1.某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示。下列判断正确的是( )
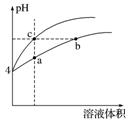
A.a、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度:a>b>c
C.b点溶液中:c(H+)+c(NH3.H2O)=c(OH-)
D.用等浓度的NaOH溶液和等体积的b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
答案 B
解析 开始盐酸与NH4Cl溶液的pH相同,可知c(NH4Cl)≫c(HCl),稀释相同倍数后,a点NH4Cl溶液中的离子浓度远大于c点盐酸的离子浓度,因而导电性不同,A错;HCl电离出的H+抑制了水的电离,所以c点溶液中水的电离程度最小,氯化铵溶液中NH的水解促进水的电离,氯化铵溶液中c(H+)越大,水的电离程度越大,综上所述a、b、c三点溶液水的电离程度a>b>c,B项正确;b点溶液中,根据质子守恒,得出c(OH-)+c(NH3.H2O)=c(H+),C项错误;b、c处溶液的pH相等,c处HCl完全电离,而b处溶液中加入NaOH溶液后,NH的水解平衡正向移动,故消耗NaOH溶液体积Vb>Vc,D项错误。