
网址:http://www.1010jiajiao.com/paper/timu/4166037.html[举报]
8.常温下,向20 mL 0.2 mol.L-1二元酸H2A溶液中滴加0.2 mol.L-1 NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
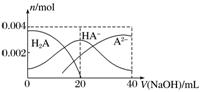
A.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D.当V(NaOH)=40 mL时,升高温度,减小
答案 C
解析 从图像看出当V(NaOH)=20 mL时,溶液中的溶质是NaHA,溶液中c(HA-)>c(A2-)>c(H2A),说明HA-以电离为主,故c(H+)>c(OH-),故A错;等体积等浓度的NaOH溶液与H2A溶液混合后的溶质是NaHA,HA-以电离为主,产生H+,抑制水的电离,故B错;等浓度H2A和NaHA的混合溶液形成缓冲溶液,溶液中存在电离平衡H2AH++HA-,水解平衡NaHA+H2ONaOH+H2A,加入酸,HA-会消耗H+生成H2A,加入碱,OH-和H2A反应生成HA-,溶液pH变化都不大,C正确;当V(NaOH)=40 mL时,溶液中的溶质是Na2A,但存在HA-,说明A2-水解,其水解平衡:A2-+H2OHA-+OH-,升高温度,A2-的水解平衡正向移动,c(A2-)减小,增大,故D错。