(一)必考题:共43分。
15.(8分)砷及其化合物广泛用于制造半导体材料以及用于医疗、农药等。回答下列问题:
(1)砷与氮同主族,原子序数比氮大26,则砷在元素周期表中的位置是_____________;砷化氢的电子式为_____________________________。
(2)H3AsO3又叫路易斯酸,是一种弱酸,发生酸式电离是通过和水中的氢氧根离子结 合实现的,则第一步电离方程式为_____________________________________________;
若常温时H3AsO3的第一步电离常数Ka1=1.0×10-9,则常温下,0.1 mol.L-1的H3AsO3
溶液的pH为___________。
(3)利用可逆的氧化还原反应+2I-+2H++I2+H2O可以设计为原电池,起始时在甲、乙两池中分别加入图示药品并连接装置。
①起始时,甲池石墨棒C1上发生的电极反应为_________________。
②一段时间后指针不发生偏转。欲使指针偏转方向与起始时相反,应采取的可行措施是_____________________________________________________(举一例)。
16.(12分)三氯化磷是一种无色液体,熔点-93.6 ℃,沸点76.1℃,PCl3,遇到水蒸气剧烈反应。实验室利用下列装置制备三氯化磷。
(1)仪器W的名称是________________,其作用是_______________________________。
(2)盛P2O5的长玻璃管的作用是_____________________________________________,浓硫酸的作用是_____________________________________________________。
(3)实验室用KMnO4与浓盐酸制取氯气的离子方程式为________________。
(4)氯气通入烧瓶中会发生燃烧,说明P4与Cl2反应的△H__________0(填“>”或 “<”)。
(5)烧瓶中得到的产物除PCl3外还可能含有_____________(填化学式),进一步精制的方法是______________________________________________________。
(6)PCl3与H2O反应的化学方程式为___________________________________________。
17.(11分)一种可利用含碘废水制取KI的实验流程如下:
回答下列问题:
(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,__________
__________________________________________________________________________。
(2)“制CuI”时,I2被还原为CuI,同时有生成。
①该反应的离子方程式为___________________________________________________。
②已知上述反应的平衡常数为1.78×1026,实验中需控制CuSO4过量2%,其目的是________________________________________________________________________。
(3)“制FeI2溶液”的化学方程式为_________________________________________;“滤
渣3”的成分是________________________(填化学式)。
(4)用HI调节溶液pH约为6,其目的是_______________________________________。
(5)准确称取产品0.1000 g溶于50 mL水,加入适量乙酸并加入曙红钠指示剂,然后 用0.025 mol.L-1AgNO3溶液滴定,至终点时消耗AsNO3溶液22.00 mL,则产品中KI的质量分数为________________(保留三位有效数字)。
18.(12分)利用铜一氯热化学循环可制取氢气,主要流程如下:
回答下列问题:
(1)图中属于氧化还原反应的是______________(填序号)。
(2)已知25℃时,Ksp(CuOH)=2.0×10-15,Ksp(CuCl)=1.0×10-6,则反应
CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq)的平衡常数K=_____________(填数值)。
(3)已知:
Cl2(g)+H2O(g)2HCl(g)+1/2O2(g) △H1
2CuCl(s)+2HCl(g)2CuCl2(s)+H2(g) △H2
Cl2(g)+2CuCl(l)2CuCl2(s) △H3
CuCl(l)CuCl(s) △H4
则反应H2O(g)H2(g)+1/2O2(g) △H=______(用△H1、△H2、△H3、△H4表示)。
(4)反应Ⅱ若在水溶液中进行可用惰性电极电解实现,其装置如下图所示。阳极的电极反应式为___________________;电解过程中阳极周围溶液的pH__________(填“升高”或“降低”)。
(5)反应Ⅰ是可逆反应,工业上也常用该反应生成的HCl制取氯气,反应为4HCl(g)+O2(g)2Cl2(g)+2H2O
(g),在不同起始投料比m下,HCl平衡转化率随温度的变化关系如下图所示:
①该反应的正反应为___________热反应(填“放”或“吸”)。
②图中m2__________m1(填“>”或“<”=。
③p kPa下,A点对应温度下反应的平衡常数Kp=_________kPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式即可)。

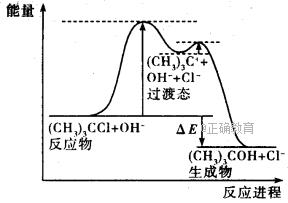
 (CH3)3COH+Cl-的能量与反应进程如图所示:
(CH3)3COH+Cl-的能量与反应进程如图所示: