
网址:http://www.1010jiajiao.com/paper/timu/4401776.html[举报]
12. (1)过滤 蒸发皿、漏斗、烧杯 (2)NH+H2O NH3.H2O+H+
NH3.H2O+H+
(3)甲丁 degfcbh
(4)Cu+4H++2NO== =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 红棕色消失 2.24 反应速率慢 无尾气处理装置
(5)滴入最后一滴AgNO3溶液,出现砖红色沉淀,半分钟不溶解 5.2mol/L
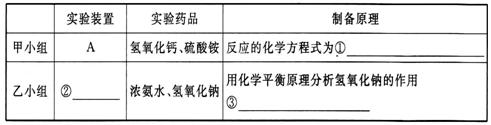
(1)①A 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O ②defel
(2) ①红棕色气体慢慢变浅 8NH3+6NO2 7N2+12H2O。
③Z中NaOH溶液产生倒吸现象 ④反应后分子数减少,Y管中压强小于外压
某小组模拟工业合成氨,并制备NaHCO3,设计实验如下(夹持装置略去)。
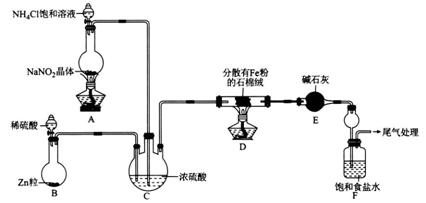
回答下列问题:
(1)装置E中盛放碱石灰的仪器名称为______________。
(2)装置A中发生反应的离子方程式为______________________。
(3)装置C的作用为使N2和H2混合均匀______________________、___________________。
(4)实验时,应先打开装置B中分液漏斗活塞,反应一段时间,在装置末端导管处收集H2并验纯后,再点燃D处酒精灯,原因为___________________________________________。
(5)当F中的氨气饱和后,取下装置F,再向其中通入足量CO2,现象为___________________;发生反应的离子方程式为________________________________。
(6)已知:Ksp(AgCl)=1.8×10-10;Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.2×10-12。该小组同学设计实验测定25℃时,NH4Cl饱和溶液的物质的量浓度。取NH4Cl饱和溶液10.00 mL,于锥形瓶中,滴加2-3滴K2CrO4溶液;用2.000 mol.L-1的AgNO3标准溶液滴定,重复滴定3次,平均消耗AgNO3溶液26.00 mL。判断达到滴定终点的方法为___________;NH4Cl饱和溶液的物质的量浓度为_____________________。
(1)干燥管
(2)NH4+ +NO3— N2 ↑+2H2O (3)干燥N2和H2 通过气泡逸出速率控制N2和H2的充入比例
(4)防止加热时空气中的O2和水蒸气与Fe反应,使Fe失去催化作用;防止H2与空气混合加热爆炸。
(5)有白色晶体析出 Na+ +CO2 +NH3+H2O =NaHCO3↓+NH4+
(6)滴入最后一滴AgNO3溶液,出现砖红色沉淀,半分钟不溶解 5.2mol/L
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:
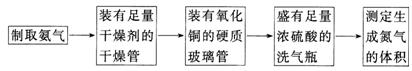
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
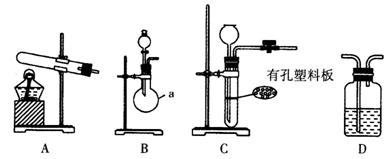
图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,生成氮气在标准状下的体积为V1L。
乙小组测得:洗气前装置D的质量为m3g,洗气后装置D的质量为m4g,生成氮气在标准状况下的体积为V2 L。
请回答下列问题:
(1)写出仪器a的名称:_____________。
(2)检查A装置气密性的操作是_____________。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填 写在下表的空格中。
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为____________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是_____________________。
为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果。该药品的名称是___________。