
网址:http://www.1010jiajiao.com/paper/timu/4502523.html[举报]
3.电子转移的表示方法
|
单线桥 |
 |
表示氧化剂与还原剂之间电子转移的方向和总数 |
|
箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素 |
||
|
箭头方向表示电子转移的方向 |
||
|
在“桥”上标明转移的是电子总数 |
||
|
双线桥 |
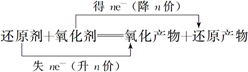 |
表示氧化剂及其还原产物、还原剂及其氧化产物之间电子转移情况 |
|
箭头必须由反应物指向生成物,且两端对准同种元素 |
||
|
箭头方向不代表电子转移方向,仅表示电子转移前后的变化 |
[巩固演练]下列有关氧化还原反应的叙述中正确的是。
①在氧化还原反应中,某元素由化合态变为单质,此元素可能被还原,也可能被氧化
②在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂
③化合物分解的产物有单质,则该分解反应必属于氧化还原反应
④化学反应K2MnO4+Cl2=2KCl+MnO2+O2属于氧化还原反应
⑤金属阳离子只有氧化性,HI只有还原性
⑥漂白粉在空气中变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生
⑦某单质X能从盐的溶液中置换出单质Y,当X、Y都是非金属时,Y一定比X活泼
⑧1molNa2O2与足量的水反应,转移的电子数为2NA
⑨5.6g铁粉与硝酸反应失去电子数一定为0.3NA

③正确;氧化还原反应的特征是反应前后元素的化合价发生改变,反应中Mn元素由+6价变为+4价,氧元素由-2价变为0价,Cl元素由0价变为-1价,④正确;金属阳离子Fe2+既有氧化性,又有还原性,HI中H+1表现氧化性,I-1表现还原性,⑤错误;漂白粉变质发生非氧化还原反应Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,发生氧化还原反应2HClO2HCl+O2↑,⑥正确;金属或非金属发生置换反应,都是活泼性强的单质,从化合物中置换出活泼性朋弱的单质,⑦错误;Na2O2与水反应时-1价的O发生歧化反应,1molNa2O2反应,只转移了1mol电子,⑧错误;铁粉与硝酸反应到底生成Fe3+还是Fe2+还是Fe3+和Fe2+的混合物,不能确定,⑨错误
[答案]①③④⑥
参考答案

2.[解析]①为二氧化锰与浓盐酸反应生成氯气、氯化锰、水,②为氯气与石灰乳反应生成氯化钙、次氯酸钙、水,③为过氧化氢分解生成水和氧气,④为氯酸钾分解生成氯化钾和氧气,⑤为铝和二氧化锰发生铝热反应生成Mn和氧化铝,均存在元素的化合价变化,均属于氧化还原反应,故A错误;⑤为铝热反应,放出大量的热,可用于制熔点较高的金属,故B正确;③中O元素的化合价由-1价升高为0,④中O元素的化合价由-2价升高为0,则相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶2,故C错误;反应①4HCl(浓)+MnO2△,MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1∶2,故D错误。[答案]B
3.[解析]A项,Na2O2既是氧化剂又是还原剂;B项,Na2O2作氧化剂,表现氧化性;C项,Na2O2作还原剂,表现还原性;D项,Na2O2既是氧化剂又是还原剂。[答案]B
4.[解析]根据氧化还原反应中,氧化性:氧化剂>氧化产物,可判断B中氧化性:Cl2>I2;C中氧化性:Co2O3>Cl2;D中氧化性:Fe3+>I2,这些结论与题给信息一致。对于A,由于I-的还原性强于Fe2+,所以Cl2应先氧化I-,而不应先氧化Fe2+。[答案]A
5.[解析]该反应的反应物中无单质,不属于置换反应;该反应实际上是不同价态的氮元素之间发生的归中反应,N2H4是还原剂,N2O4是氧化剂,N2既是氧化产物又是还原产物。[答案]D

7.[解析]气体所处温度和压强未知,无法由体积求物质的量,A项错误;氢化锂中的氢是-1价,与水发生归中反应,方程式为LiH+H2O===LiOH+H2↑,所以氢化锂也是一种储氢材料,B项正确;LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4完全分解,转移3 mol电子,生成1.5 mol的氢气,由LiAlH4+2H2O===LiAlO2+4H2↑生成4 mol的氢气转移4 mol的电子,所以生成1 mol的氢气转移电子分别为2 mol和1 mol,所以反应①、②生成等质量的H2转移电子数之比为2∶1,C项错误;LiAlH4是离子化合物,LiH是离子化合物,D项错误。[答案]B
8.[解析](1)通入一段时间N2,排出装置中的氧气。(2)氯气和二氧化硫都是有毒气体,可以用氢氧化钠来吸收。(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水。(4)SO2通入酸性高锰酸钾溶液中二者可以发生氧化还原反应。(5)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则铁离子的氧化性大于二氧化硫;丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则铁离子的氧化性大于二氧化硫。
[答案](1)排出装置中的空气,防止干扰(2)NaOH溶液(3)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(4)2MnO+5SO2+2H2O===2Mn2++5SO+4H+(5)乙、丙
9.[解析](1)根据化合物中化合价的代数和为零的原则,可知NaClO2中Cl的化合价为+3价。(2)由工艺流程图可知,“反应”步骤中的反应物为NaClO3、H2SO4和SO2,生成物为NaHSO4和ClO2,则反应的化学方程式为2NaClO3+H2SO4+SO2===2NaHSO4+2ClO2。(3)由于Mg(OH)2的溶解度比MgCO3更小,CaCO3的溶解度比Ca(OH)2更小,所以为了能更完全地除去粗盐
水中的Mg2+和Ca2+,要加入的试剂分别为NaOH溶液和Na2CO3溶液,电解时在阴极发生还原反应,氯元素化合价降低,产物为NaClO2。(4)由题意可知,“尾气吸收”是利用NaOH和H2O2溶液吸收“电解”过程排出的少量ClO2,生成的是NaClO2,则此吸收反应发生的化学反应方程式为2NaOH+H2O2+2ClO2===2NaClO2+2H2O+O2,其中ClO2是氧化剂,H2O2是还原剂,其物质的量之比为2∶1,该反应中的氧化产物是O2。(5)NaClO2在杀菌消毒的过程中被还原为Cl-,则1 mol NaClO2得到电子的物质的量为4 mol,1 mol Cl2被还原为Cl-时得到电子的物质的量为2 mol,故1 g NaClO2得到电子的物质的量为4/90.5 mol,根据“有效氯含量”的定义可知,NaClO2的有效氯含量为1.57。
[答案](1)+3 (2)2NaClO3+H2SO4+SO2===2NaHSO4+2ClO2(3)NaOH溶液 Na2CO3溶液 ClO(或NaClO2) (4)2∶1 O2(5)1.57

[答案](1)①2Mn2++O2+4OH-===2MnO(OH)2②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O(2)①排出装置内的空气,避免空气中的O2的干扰 ⑦淀粉溶液 ⑧滴最后一滴标准液,溶液恰好由蓝色变为无色,且半分钟内不恢复原色(3)①7.8 ②偏大
11.[解析](1)由题“锰酸锂、碳粉等涂覆在铝箔上”,可知碱溶的是Al得NaAlO2,通CO2得Al(OH)3沉淀。(2)“酸溶”反应物是LiMn2O4、O2、H2SO4,生成物有MnO2、K2SO4及H2O。注意过滤得LiMn2O4,说明LiMn2O4不溶于水,Li2SO4溶于水。(3)由图可知加入Na2CO3沉淀出Li2CO3,和Na2CO3反应有Li2SO4及过量的H2SO4。工业洗涤Li2CO3用热水不用冷水,说明在热水中Li2CO3的溶解度小。(4)①反应物有MnO2、Li2CO3,MnO2→LiMn2O4,锰元素的化合价降低,说明有元素化合价升高,分别各元素化合价,说明有O2生成,生成物有LiMn2O4、CO2和O2。②由表中数据可知随温度的升高,Mn4+的含量先变大后变小。
[答案](1)Al(OH)3(2)4LiMn2O4+O2+4H+===4Li++8MnO2+2H2O(3)Li2SO4 H2SO4 降低Li2CO3的溶解度,减少溶解(4)①8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑②先变大,后变小