
网址:http://www.1010jiajiao.com/paper/timu/4504950.html[举报]
1.基态原子是处于能量最低状态的原子。
参考答案
一、1.能量低 能量较高 最低 不同 不同的原子轨道 相同
2.< < < < < < <
二、1.电子数 原子轨道
2. (1) _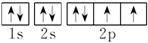 。
。
(2)  。
。
课堂互动探究
一、 例1 [解析] (1)对于C原子来说,2p有3个能量相同的原子轨道,2p上的2个电子应该以自旋方向相同的方式分布在两个不同的2p轨道上。
(2)根据轨道能量高低顺序可知E4s<E3d,对于21Sc来说,最后3个电子应先排满4s,再排3d,应为
1s22s22p63s23p63d14s2。
(3)对于22Ti来说,3p共有3个轨道,最多可以排6个电子,不能排10个电子。
[答案] (1)洪特规则 (2)能量最低原理
(3)泡利不相容原理
变式训练
1.[解析] (1)Si的原子序数为14,则核外电子数为14,电子排布式为1s22s22p63s23p2,依据核外电子能量排布原理,电子由离核近的区域依次由里向外排布,所以电子占据的最高能层符号为M,该能层具有的原子轨道为s、p、d轨道,共计9个原子轨道,电子数为4。
(2)硅元素在地壳中的含量居第二位,自然界中硅元素主要以硅酸盐和二氧化硅的形式存在,无游离态的硅。
[答案] (1)M 9 4 (2)二氧化硅
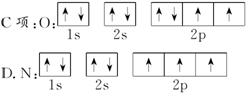
二、例1[解析] A项违背洪特规则;B项S2-最外层有8个电子;C项中N原子2p上是3个电子且自旋方向标错。
[答案] D
变式训练
2.[解析] 由题意可知A元素的L层已填满,共有8个电子,可得A的M层上有14个电子,则A的第三层电子排布为3s23p63d6,可得A的核外电子排布式为1s22s22p63s23p63d64s2,即A为Fe原子,其两种阳离子为Fe3+和Fe2+,阳离子a的电子排布式为1s22s22p63s23p63d5,阳离子b的电子排布式为1s22s22p63s23p63d6,再根据洪特规则,a的3d轨道处于半充满状态,a比b稳定。
[答案] (1)13 6 大于 (2)1s22s22p63s23p63d64s2(或[Ar]3d64s2)

例 [解析] 由原子核外电子排布的轨道能量顺序①同一能层的能量高低顺序为:ns<np<nd<nf;②不同能层之间会产生能级交错现象,即能层序数大,其能级的能量不一定高,如3d具有的能量介于4s和4p具有的能量之间。根据原子核外电子排布的轨道能量顺序不难比较各能级能量的大小。
[答案] (1)< (2)< (3)> (4)< (5)< (6)<
当堂双基达标
1.[解析] p有三个原子轨道,据泡利不相容原理,每个轨道最多排布2个电子,故p原子轨道最多排布6个电子,不可能排布7个电子,故违背泡利不相容原理。
[答案] A
2.[解析] 基态原子的电子排布式是能量最低的。A项1s未排满。
[答案] A
3.[解析] B项中Cr:[Ne]3s23p63d54s1
[答案] A
4.[解析] D项平面镜成像是一种物理现象,不存在电子的跃迁;A、B、C三项中物质变化均与原子核外的电子跃迁有关。
[答案] D
5.[解析] 根据洪特规则,电子在能量相同的各个轨道上排布时尽可能分占不同的原子轨道,且自旋状态相同。只有符合核外电子排布原理的状态才是能量最低状态。
[答案] B A中核外电子排布违背了洪特规则。
6.[答案] 能量最低 泡利不相容
1s22s22p63s23p2 3s23p2
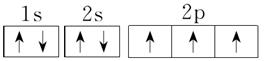
7.[解析] Cu的电子排布式是1s22s22p63s23p63d104s1,所以其原子结构示意图是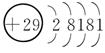 ;P的外围电子排布式为3s23p3;Fe的电子排布式为1s22s22p63s23p63d64s2;N的电子排布式为1s22s22p3,所以其轨道表示式是
;P的外围电子排布式为3s23p3;Fe的电子排布式为1s22s22p63s23p63d64s2;N的电子排布式为1s22s22p3,所以其轨道表示式是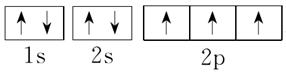 。X元素出现了4p层,说明3d层已经排满,其电子排布式为1s22s22p63s23p63d104s24p5,原子序数是35,为溴元素。
。X元素出现了4p层,说明3d层已经排满,其电子排布式为1s22s22p63s23p63d104s24p5,原子序数是35,为溴元素。
[答案] (1) 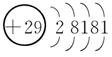
(2)3s23p3 (3)1s22s22p63s23p63d64s2
(4) 
(5)Br