
网址:http://www.1010jiajiao.com/paper/timu/4838979.html[举报]
16. (12分)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
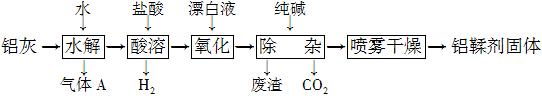 (1) 气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90 ℃而不在室温下进行的原因是____。
(1) 气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90 ℃而不在室温下进行的原因是____。
(2) “酸溶”时,Al2O3发生反应的离子方程式为____。
(3) “氧化”时,发生反应的离子方程式为____。
(4) “废渣”成分为________(填化学式)。
(5) 采用喷雾干燥而不用蒸发的原因是____。
化学参考答案及评分标准
1. D 2. C 3. D 4. D 5. B 6. A 7. C 8. C 9. B 10. C 11. A 12. BD 13. C
14. CD 15. BD
16. (12分)
(1) AlN+3H2OAl(OH)3+NH3↑(2分)
加快AlN水解反应速率;降低NH3在水中的溶解度,促使NH3逸出(2分)
(2) Al2O3+6H+===2Al3++3H2O(2分)
(3) 2Fe2++2H++ClO-===3Fe3++Cl-+H2O(2分)
(4) Fe(OH)3(2分)
(5) 防止Al(OH)2Cl水解生成Al(OH)3(2分)
17. (15分)
(1) 羧基(1分) 硝基(1分)
 18. (12分)
18. (12分)
(1) 淀粉溶液(2分)
(2) 偏高(2分)
(3) 关系式:ClO--I2-2S2O
n(ClO-)=1/2n(S2O)=1/2×0.800 0 mol.L-1×25.00×10-3 L=1.000×10-2 mol(1分)
n(Mg2+)=0.020 00 mol.L-1×25.00×10-3 L×1 000 mL/25.00 mL=2.000×10-2 mol(1分)
根据电荷守恒,可得:
n(OH-)=2n(Mg2+)-n(ClO-)
=2×2.000×10-2 mol-1.000×10-2 mol=3.000×10-2 mol(2分)
n(H2O)=1.685 g-1.000×10-2 mol×51.5 g.mol-1-2.000×10-2 mol×24 g.mol-1-3.000×10-2 mol×17 g.mol-1=0.180 g(1分)
n(H2O)=0.180 g/18 g.mol-1=1.000×10-2 mol(1分)
n(Mg2+)∶n(ClO-)∶n(OH-)∶n(H2O)
=2.000×10-2 mol∶1.000×10-2 mol∶3.000×10-2 mol∶1.000×10-2 mol
=2∶1∶3∶1(1分)
碱式次氯酸镁的化学式为Mg2ClO(OH)3.H2O(1分)
19. (15分)
(1) 使海水中的溴元素富集(2分)
(2) 5Br-+BrO+6H+===3Br2+3H2O(2分)
(3) 使A中Br2进入B瓶中(2分) 平衡压强(2分) NaOH溶液或Na2CO3溶液(2分)
(4) ① 将酸化后产生的气体通过盛有四氯化碳的洗气瓶后,再通入澄清石灰水中,若石灰水变浑浊,则证明烧瓶B的溶液中含有CO(3分)
② 将酸化后的溶液加入到蒸馏烧瓶中进行蒸馏,得到溴单质(或用四氯化碳进行萃取并分液后蒸馏)(2分)
20. (14分)
(1) -1 250.3 kJ.mol-1(2分)
(2) 350 ℃左右、3%(每点1分,共2分)
(3) ① 3O3+2NO+H2O===2HNO3+3O2(2分)
② 3H2O-6e-===O3↑+6H+(2分)
(4) ① N2(2分) ② 44.8 L(2分)
(5) N2O、NO2(每个1分,共2分)
21A. (12分)
(1) 1s22s22p63s23p63d6或[Ar]3d6(2分)
(2) V形(2分) sp2杂化(2分)
NO或CO(1分) BF3或COCl2等(1分)
(3) 13 mol或13×6.02×1023(2分)
(4) MgAl2O4(2分)
21B. (12分)
(1) 防止苯胺被氧化,同时起着沸石的作用(2分)
(2) 温度过高,未反应的乙酸蒸出,降低反应物的利用率(2分);温度过低,又不能除去反应生成的水(2分)
(3) 若让反应混合物冷却,则固体析出沾在瓶壁上不易处理(2分)
吸滤瓶(1分) 布氏漏斗(1分)
(4) 重结晶(2分)