
网址:http://www.1010jiajiao.com/paper/timu/505539.html[举报]
4.在一个体积为2 L的真空密闭容器中加入0.5 mol CaCO3,发生反应CaCO3(s)CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如下图所示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
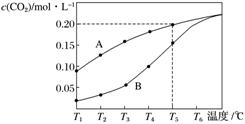
(1)该反应正反应为______热反应(填“吸”或“放”),温度为T5 ℃时,该反应耗时40 s达到平衡,则T5℃时,该反应的平衡常数数值为________。
(2)如果该反应的平衡常数K值变大,该反应________(选填编号)。
a.一定向逆反应方向移动
b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动
d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:
___________________________________。
(4)保持温度,体积不变,充入CO2气体,则CaCO3的质量________,CaO的质量________,CO2的浓度________(填“增大”、“减小”或“不变”)。
(5)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入0.5 mol N2,则最后平衡时容器中的CaCO3的质量为________ g。
答案 (1)吸 0.2 (2)bc (3)随着温度升高,反应速率加快,达到平衡所需要的时间变短 (4)增大 减小 不变 (5)10
解析 (1)T5 ℃时,[CO2]=0.20 mol.L-1,
K=[CO2]=0.20 mol.L-1。
(2)K值增大,平衡正向移动,正反应速率大于逆反应速率。
(4)体积不变,增大[c(CO2)],平衡左移,CaCO3质量增大,CaO质量减小,由于温度不变,K不变,所以c(CO2)不变。
(5)保持体积、温度不变,充入N2,平衡不移动,[c(CO2)]仍等于0.20 mol.L-1,其物质的量为0.4 mol,所以剩余CaCO3的物质的量为0.5 mol-0.4 mol=0.1 mol,其质量为10 g。
借助平衡常数可以判断一个化
学反应是否达到化学平衡状态
对于可逆反应aA(g)+bB(g)cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:
=Q,称为浓度商。
Q
考点四 有关化学平衡的计算
