
网址:http://www.1010jiajiao.com/paper/timu/600975.html[举报]
3.聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%-34%)、SiO2(40%-50%)、Fe2O3(0.5%-3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:

根据流程图回答下列问题:
⑴“煅烧”的目的是_________________________________________________________。
⑵配制质量分数15%的盐酸需要200 mL 30%的浓盐酸(密度约为1.15 g.cm-3)和_______ g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
⑶“溶解”过程中发生反应的离子方程式为__________________________________________。
⑷加少量铝粉的主要作用是_____________________________________。
⑸“调节溶液pH在4.2-4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90-100℃,控制温度的实验方法是_________________。
解析:对比原料与产品可知,该生产的主要工序:一是除去原料高岭土中的杂质,二是将Al2O3利用水解絮凝法转化为产品。再进一步分析,除铁用铝置换后过滤,高岭土中的Al2O3不溶于酸,必须经煅烧改变结构。该题经这样分析,题设的所有问题的答案就在分析之中。
答案:
⑴改变高岭土的结构,使其能溶于酸;
⑵230;量筒;
⑶Al2O3+6H+=2Al3++3H2O
Fe2O3+6H+=2Fe3++3H2O;
⑷除去溶液中的铁离子;
⑸pH计(或精密pH试纸);水浴加热
4、在已知提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘: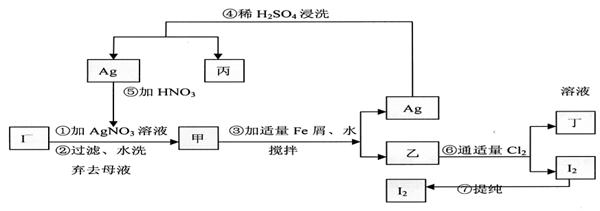
试回答:
(1)乙、丁中溶质的分子式:乙 ,丁 。
(2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号)
a.除去未反应的NO3- b.除去未反应的I- c.除去未反应的Fe d.除去碱性物质
(3)第⑦步操作可供提纯的两种方法是 和 (不要求写具体步骤)。
(4)实验室检验I2的方法是 。
(5)甲物质见光易变黑,其原因是(用化学方程式表示) 。
(6)①中溶解银的硝酸应该用 硝酸(填浓或稀)。
原因是 。
(1)FeI2 FeCl3
(2)C
(3)升华、凝华、萃取、分液、减压蒸馏
(4)将I2加在淀粉溶液中,溶液显蓝色
|
(5)2AlI===== 2Ag +I2
(6)稀(2分) 减少过程中产生NOx的量;节生硝酸物质的量
5、工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下:
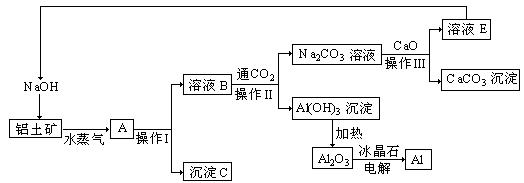
请回答下列问题:
(1)水蒸气的作用 。
(2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________。
(3)操作I、操作II、操作III都用到的玻璃仪器是有________________。
(4)实验室洗涤Al(OH)3沉淀应该如何操作: 。
(5)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
(1)加热加快反应
(2)Fe2O3 颜料;
(3)烧杯、漏斗、玻璃棒;
(4)用玻璃棒引流向过滤器中加水浸没沉淀,滤去洗液后,反复2到3次即可。;
(5)CaO和CO2 Fe2O3和O2;
6.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
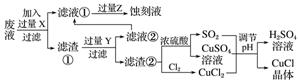
根据以上信息回答下列问题:
(1)写出生产过程中X________,Y________。
(2)写出产生CuCl的化学方程式:______________________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:________________________________________________________________________
________________________________________________________________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是________________________________________________________________________
________________________________________________________________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
|
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
CuCl产率 |
70 |
90 |
82 |
78 |
75 |
72 |
70 |
析出CuCl晶体最佳pH为________,当pH较大时CuCl产率变低的原因是________________
________________________________________________________________________________________________________________________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10mol.L-1硫酸铈[Ce(SO4)2]标准溶液滴定。已知:CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
|
平行实验次数 |
1 |
2 |
3 |
|
0.25g样品消耗硫酸铈标准溶液的体积(mL) |
24.35 |
24.05 |
23.95 |
则样品中CuCl的纯度为________(结果保留三位有效数字)。
答案 (1)Fe 稀盐酸
(2)CuCl2+CuSO4+SO2+2H2O===2CuCl↓+2H2SO4
(3)反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O中生成的CuSO4和SO2为1∶1,所以理论上不需要补充SO2气体
(4)生产中应防止CuCl的氧化和见光分解
(5)2 pH较大时,Cu2+水解程度增大,反应生成的CuCl减少
(6)0.955(或95.5%)
解析 (1)废液中含有Fe3+、Cu2+,应加入Fe除去,过量的Fe用稀盐酸除去,所以试剂X、Y分别是Fe、稀盐酸。(2)由流程图可知,CuCl晶体的制备过程中,反应物为SO2、CuSO4、CuCl2,生成物为H2SO4、CuCl,由化合价升降守恒及原子守恒,可得反应方程式为CuCl2+CuSO4+SO2+2H2O===2CuCl↓+2H2SO4。(3)由反应方程式Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O可知,Cu与浓硫酸反应的过程中有SO2生成,且生成的CuSO4和SO2为1∶1,生产CuCl的过程中消耗CuSO4和SO2也为1∶1,所以理论上不需要补充SO2气体。(4)因CuCl在空气中迅速被氧化成绿色且见光分解,变成褐色,故生产中应注意防止CuCl的氧化和见光分解。(5)由表中数据可知,pH=2时,CuCl产率最高;pH较大时,Cu2+水解程度增大,导致反应生成的CuCl减少。(6)滴定0.25g样品消耗硫酸铈标准溶液的平均体积是24mL,所以CuCl的纯度为(24×10-3L×0.10mol.L-1×99.5g.mol-1)/0.25g×100%≈95.5%。
7.硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5.H2O,硼砂的化学式为Na2B4O7.10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程如下:
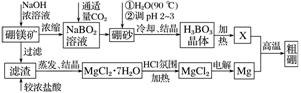
回答下列有关问题:
(1)硼砂中B的化合价为__________,溶于热水后,常用H2SO4调pH到2-3制取H3BO3,反应的离子方程式为_________________________________________________________。
X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为________________________________________________________________________
________________________________________________________________________,
该反应中的氧化剂是(填化学式)_______________________________________________
_________________________。
(2)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,这一变化的化学方程式为____________________________。皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,则硼酸与氢氧化钠反应的离子方程式为________________________________________________________________________。
(3)MgCl2.7H2O需要在HCl氛围中加热制MgCl2,其目的是____________________________
____________________________________________。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol.L-1Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为________(填“酸式”或“碱式”)滴定管。该粗硼样品的纯度为________(提示:I2+2S2O===2I-+S4O)。
答案 (1)+3 B4O+2H++5H2O===4H3BO3
3Mg+B2O32B+3MgO B2O3
(2)H3BO3+H2O[B(OH)4]-+H+
H3BO3+OH-===[B(OH)4]-
(3)防止MgCl2水解生成Mg(OH)2
(4)碱式 99%(或0.99)
解析 (4)2BI3===2B+3I2
I2+2S2O===2I-+S4O
n(B)=n(I2)=×n(S2O)
=×18×10-3L×0.30mol.L-1
=1.8×10-3mol
所以样品纯度为×100%=99%。
8.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3.6H2O)的工艺流程如下:
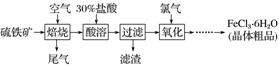
(1)氧化过程中发生反应的离子方程式是_____________________________________________
_____________________,检验氧化生成的阳离子的试剂是__________________________。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。
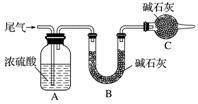
①C仪器的名称是________,该装置的作用是________________________________________
________________________________________________________。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理____________(填“是”或“否”),请说明理由_____________________
___________________________________________________________________________________________________________________________(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是____________________________________________________
____________________。
②进行沉淀洗涤的方法是_______________________________________________________。
③SO2含量的表达式是______________________(用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3.6H2O晶体的操作包括____________、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因___________________________________
________________________________________________________________________。
答案 (1)2Fe2++Cl2===2Cl-+2Fe3+ KSCN溶液
(2)方案一:①球形干燥管 防止空气中的水蒸气、CO2被B装置吸收
②否 尾气中的CO2也能被B装置吸收使所测质量分数偏大
方案二:①使生成的SO完全转化为沉淀
②在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2-3次此操作
③%
(3)蒸发浓缩 Fe3++3H2OFe(OH)3+3H+,过量盐酸能够抑制Fe3+水解
解析 工艺流程中的物质转化关系是:
FeS2FeCl3溶液-→FeCl3.6H2O
(1)Cl2把Fe2+氧化成Fe3+,检验Fe3+应选用KSCN溶液。
(2)①干燥管的作用是为了防止外界CO2和H2O(g)进入B装置,干扰测定结果;
②因为CO2也能被碱石灰所吸收,所以该方案不合理。方案二的原理是,利用溴水把SO2氧化成H2SO4,再加入BaCl2生成BaSO4沉淀,通过BaSO4沉淀的质量来确定SO2的含量;
③×100%。
(3)因为FeCl3水解生成具有挥发性的盐酸,所以应保持盐酸过量,抑制Fe3+的水解。