|
试题详情
? 刮取没有燃烧的火柴头,小心研碎,称得质量为2.45g; ? 用适量蒸馏水充分浸泡后过滤、洗涤残渣; ? 往装有滤液和洗涤液的烧杯中加入过量的NaNO2溶液、AgNO3溶液, 有白色沉淀生成,充分反应后,过滤、洗涤沉淀; 试题详情
? 干燥沉淀物,称得其质量为1.435g。 ① 实验中发生的有关的离子反应方程式为
。 ②
实验测得火柴头中KClO3的质量分数为
; 试题详情
28、(16分)乙偶姻是一个极其重要的香料品种,主要用于配制奶香型、肉香型、草莓香型香精,也可用于合成其他精细化学品。已知乙偶姻中只含有C、H、O三种元素,其密度是相同条件下乙醛的2倍,分子中C、H、O原子个数比为2:4:1 。请回答: (1)乙偶姻的分子式为___________。 (2)X是乙偶姻的同分异构体,属于酯类,写出其结构简式(两种即可) __________________________________ ,__________________________________。 已知在乙偶姻中含有碳氧双键,A的一氯代物只有一种,且不发生银镜反应。与乙偶姻有关的反应如下: 试题详情
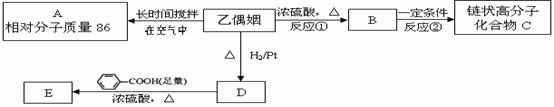
(3)写出反应①、②的反应类型:反应① ___________、反应② ___________。 (4)写出A、乙偶姻、C的结构简式: A
___________________、乙偶姻 __________________、C_________________。 (5)写出D → E反应的化学方程式 __________________________________________________________________________。 试题详情
29、(21分)在牧草中,白花三叶草有两个稳定遗传的品种,叶片内含氰(HCN)的和不含氰的。现已研究查明,白花三叶草的叶片内的氰化物是由体内的前体物质经过复杂的生化途径转化而来。其中基因D、H分别决定产氰糖苷酶和氰酸酶的合成,基因d、b则无此功能。现有两个不产氰的纯合亲本杂交,F1全部产氰,F1自交得F2,F2中有产氰的,也有不产氰的。现用F2中各表现型的叶片提取液作实验,实验时在提取液中分别加入含氰糖苷和氰酸酶,然后观察产氰的情况,结果记录于下表: 叶片 表现型 提取液 提取液中加入含氰糖苷 提取液中加入氰酸酶 叶片Ⅰ 产氰 含氰 产氰 产氰 叶片Ⅱ 不产氰 不含氰 不产氰 产氰 叶片Ⅲ 不产氰 不含氰 产氰 不产氰 叶片Ⅳ 不产氰 不含氰 不产氰 不产氰 据表回答问题: (1)
根据题干所给信息推测白花三叶草叶片内的氰化物产生的生化途径:
。 (2)从白花三叶草的叶片内的氰化物产生的生化途径可以看出基因与生物性状的关系是___ __________________________;__________________________________________。 (3)亲代两个不产氰品种的基因型是
,在F2中产氰和不产氰的理论比为 。 (4)叶片Ⅱ叶肉细胞中缺乏
酶,叶片Ⅲ可能的基因型是
_ _____________ 。 (5)从代谢的角度考虑,怎样使叶片Ⅳ的提取液产氰?_______________________。理由是_____________________________________________
。 试题详情
30、(21分)用某种大小相似的农作物绿色叶片,分组进行实验:已知叶片实验前的重量,在不同温度下分别暗处理1小时,测其重量变化;立刻再光照1小时(光强度相同),再测其重量变化。得到如下结果: 组别 一 二 三 四 温度 27℃ 28℃ 29℃ 30℃ 暗处理后的重量变化(mg)* -1 -2 -3 -4 光照后的重量变化(mg)* +3 +3 +3 +2 * 指与暗处理前的重量进行比较,“―”表示减少的重量值,“+”表示增加的重量值 试题详情
 请回答问题: 请回答问题:
(1)假如叶片的重量变化都是光合作用所合成的有机物的量,请根据表中所测数据情况在左边的坐标图中画出光合作用实际合成有机物量的曲线。 (2)从上面所画的坐标曲线可以看出,在相同光照强度下,温度从27℃升到30℃的过程中,光合作用强度______________。但超过 29℃后的一定温度范围内,光合作用强度增加的幅度________,可能影响的外界因素有____________等。 (3)有人认为在相同日温(较适宜)下,夜温低于0℃或高于20℃时,绿叶蔬菜的产量都不理想。请你设计实验,探究日温在29℃夜温控制在多少度范围时,人工大棚中种植绿叶蔬菜,收获的绿叶蔬菜产量较高(怎样控制温度不作要求)。 ①该实验的自变量是__________________________________。 ②实验的方法步骤: 第一步:取同种的、枝叶数量、大小、重量和健康状况等相同(或相近)的绿叶蔬菜幼苗若干,均分5组; 第二步:__________________________________________________________________; 第三步:__________________________________________________________________。 ③结果分析:______________________________________________________________ _______________________________。 试题详情
31、(12分)最近有科研工作者分离到了一种能分解竹纤维的微生物,这种微生物能高效分解竹纤维产生葡萄糖,再利用葡萄糖发酵生产生物燃料酒精,以解决一部分生物燃料不足问题,很有市场前景。 (1)微生物能利用竹纤维是因为其能分泌_______酶等。如果在显微镜下观察该种竹纤维的微生物,发现其细胞结构中无完整的细胞核,则该微生物属于___________,从它在生态系统中的功能看属于____________。 (2)完成下列操作步骤: ①土壤取样:到_______________________________________________采集土样。 ②制备培养基:培养基的基本成分中有碳源 、_______、___________和__________,其中的碳源以_____________代替。将配制好的培养基、接种用具等进行 处理。 ③选择培养:将采集来的样品采用____________法,在酒精灯火焰旁接种到培养基中,置于恒温箱中培养一段时间。 (3)如果分离得到的纤维素分解菌,不能高效分解竹纤维产生葡萄糖。则可以通过_ ______________、__________________等技术获得高效纤维素分解菌。 黄山市2009届高三年级理科综合试卷 试题详情
物理部分答案 一、选择题(本题共7小题。在每小题给出的四个选项中,只有一个选项正确。) 14、C 15、C 16、D 17、C 18、D
19、B 20、B 、非选择题 (共4大题,共68分) 21(18分)Ⅰ:(1)B C (4分)(2)重力的分力与摩擦力平衡,砂桶的质量远小于小车质量(2分)  (3)B(2分) (3)B(2分)
Ⅱ:(1)电路图如图所示(4分) (2)若干组电流表的读数和电阻箱的读数(2分) (3) (2分), (2分), (2分) (2分) 22(14分)解析:(1)设A、B的质量分别为m、M,滑到水平面上时的速度分别为vA、vB,根据机械能守恒定律得:  , , ……3分 ……3分
解得: , , ……2分 ……2分 (2)设A、B两物体在斜面上运动的时间分别为tA、tB, 根据牛顿第二定律求得A、B两物体下滑的加速度均为: ……2分 ……2分 由运动学公式得:vA = a tA , tA = 0.4 s ……1分 vB = a tB , tB = 0.8 s ……1分 在水平面上两物体均作匀速运动,当B追上A时有:  ……3分 ……3分
解得:t = 1.2 s ……2分 23(16分)解析:(1)ab杆匀速下滑时,流过ab杆的电流: ……2分 ……2分 根据闭合电路欧姆定律得: ……2分 ……2分 ab杆切割磁感线产生的感应电动势: ……1分 ……1分 解得:v = 6 m/s ……1分 (2)金属杆匀速下滑时,速度达到最大值,即:v = 6 m/s ……1分 设导轨倾斜角度为θ,分析金属杆受力可得: ……2分 ……2分 设ab杆开始下滑到达到最大速度的过程中的位移为x 由: ……1分 ……1分  ……1分 ……1分
灯泡电阻: ……1分 ……1分 解得: ……1分 ……1分 由功能关系得: ……2分 ……2分 解得:Q = 0.12 J ……1分 24(20分)解析:(1)小球A在电场中做类平抛运动,在电场中沿x、y轴方向上的位移分别设为x1、y1。  ……1分, ……1分,
 …1分 …1分
 ……1分 ……1分
vx
= v0 , vy=at1 ……1分 解得: y1=0.08 m
……1分 vy=at1=3.2m/s  所以,小球A第一次进入磁场时的速度为: 所以,小球A第一次进入磁场时的速度为: ……1分 ……1分
方向与y轴正方向成370 。……1分 (2)小球A在磁场中做匀速圆周运动,垂直于x轴进入第4象限,做出小球A运动的轨迹如图,设轨道半径为R1,由几何关系可得:  (m)……2分 (m)……2分
根据: ……2分 ……2分 解得: (T)……1分 (T)……1分 (3)在第4象限内A与C球发生完全非弹性碰撞,碰撞后速度设为v2,在磁场中做圆周运动的轨道半径设为R2。  ……2分, ……2分,
 ……1分 ……1分
解得: ……1分 ……1分 即:小球运动的轨道半径不变 由周期公式: ……1分 ……1分 可得:碰撞后小球的速度小,故碰后的周期大,所以要使小球A在第4象限内运动的时间最长,小球C应放在小球A进入第4象限时的位置: ……2分 (或由 ,可知碰后的质量大,周期大,作出判断) ,可知碰后的质量大,周期大,作出判断)  ……1分 ……1分
即坐标为(24,0) 化学部分答案 一、选择题(本题包括7小题,每小题6分,,每小题只有一项是符合题目题意) 7、B 8、B 9、A 10、D 11、C 12、B 13、B 二、填空题(本题包括四大题,共58分) 25、(14分) (1)、离子键、共价键 (2分) 0.2NA 或1.024×1023
(2分) (2)、Cl2+2OH-= Cl- + ClO- +H2O (2分) Cl:1s22s22p63s23p5 (2分) (3)、 C、浓H2SO4 (各1分)(浓字没写扣1分) (4)、2NH4Cl+Ca(OH)2 CaCl2 +2H2O+2NH3↑(2分) CaCl2 +2H2O+2NH3↑(2分) (5)、MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分)(14分) Mn2++Cl2↑+2H2O (2分)(14分) 26、(14分) (1)N2H4(g)+ O2(g)=N2(g)+2H2O(g); △H=-534kJ/mol (2分) (2) O2+2H2O+4
e― = 4OH― (2分) (3)①大于(2分) ②0.25mol (2分) (4)N2H5+
+ H2O = N2H4?H2O + H+ (2分) (5) > (2分) (6) > (2分) 27、(14分) (1)2KClO3 2KCl+3O2↑ (2分) S+O2
2KCl+3O2↑ (2分) S+O2 SO2 ( 2分) SO2 ( 2分) (2)①酸性高锰酸钾溶液溶液(紫红色)褪色 (2分)
② A、C ( 2分) (3)取滤液C,加入AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素。(2分)(回答加入酸化的AgNO3溶液或用HNO3酸化的AgNO3溶液均可) (4)①ClO3¯+3NO2¯+Ag+=AgCl↓+3NO3¯
(2分) ② 50%; (2分) 28、(16分)(1)C4H8O2 (2分) (2)HCOOCH2CH2CH3  CH3COOCH2CH3 CH3CH2COOCH3(2×2分) CH3COOCH2CH3 CH3CH2COOCH3(2×2分) (3)消去反应(1分) 加聚反应 (1分) (4)   (3×2分) (3×2分) (5) (2分) (2分) 生物部分答案 一、选择题(每小题6分,共36分) 1、C 2、C 3、B 4、C 5、B 6、D 二、非选题(共计3小题,共计54分) 29、(共21分,除特别注明外,每空2分)
产氰糖苷酶
氰酸酶
  (1) 前体物质
含氰糖苷
氰化物
(3分) (1) 前体物质
含氰糖苷
氰化物
(3分)
(2)多个基因决定一个性状
基因通过控制酶的合成控制生物的代谢从而控制生物的性状 (3)DDhh ddHH 9∶7 (4)氰酸 ddHH或ddHh(只写一种不给分)  (5)同时加入含氰糖苷和氰酸酶 因为含氰糖苷在氰酸酶的作用下能产氰(6分) (5)同时加入含氰糖苷和氰酸酶 因为含氰糖苷在氰酸酶的作用下能产氰(6分)
30、(共21分)(1)见右图(4分) (2)逐渐增强(2分) 放慢(或减缓)(2分) 光照强度(或CO2浓度)(2分) (3)①夜温的不同(2分) ②第二步:将5组绿叶蔬菜幼苗种植在相同土质中,日温控制在29℃,夜温分别控制在0℃、5℃、10℃、15℃、20℃,光照强度及光照时间、水肥管理等条件完全相同(其他答案合理也给分,3分); 第三步:一段时间后(或1个月后)分组收获绿叶蔬菜,去泥沙称重,记录并进行比较(3分)。 ③那一组绿叶蔬菜重量最重,产量最高,其对应的温度即为适宜的夜温(或有两组产量相差不大,则其对应的夜温区间即为适宜的夜温范围)(3分)。 31、(共12分,每空1分) (1)纤维素 原核生物 分解者 (2)①有多年积累的竹枝败叶处 将竹杆加工成细颗粒埋在土壤中,一段时间后从已腐烂的竹粒处(其他答案正确也给分)
②氮源 水 无机盐 竹纤维 灭菌 ③稀释涂布平板 (3)基因工程 人工诱变
| 


 B.不法商贩在奶粉中掺杂了三聚氰胺(分子结构如右图所示),其含氮量高达93.3%
B.不法商贩在奶粉中掺杂了三聚氰胺(分子结构如右图所示),其含氮量高达93.3%
 时有气体产生,当溶液的PH=13时(常温下)能产生沉淀。符合上述要求的一组是 ( )
时有气体产生,当溶液的PH=13时(常温下)能产生沉淀。符合上述要求的一组是 ( )

 Cl- D、
Cl- D、


