
2009届湖南省长沙市一中高三第六次月考化学
注意事项:
1.考试结束后,考生只交答题卡;
2.答卷前将密封线内的项目填写清楚。
3.用钢笔或圆珠笔将各题答案直接写在答卷纸上。
4.以下数据可供解题时参考
可能用到的相对原子质量
H:
Ag:108
第I卷(选择题,共51分)
一、选择题(本题包括17小题,每小题3分,共51分。每小题只有1个选项符合题意)
1.①丁烷;②2-甲基丙烷;③正戊烷;④2―甲基丁烷;⑤2,2―二甲基丙烷等物质的沸点的排列顺序正确的是( )
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
2.用铁酸钠(Na2FeO4)对未来河湖的淡水消毒是城市饮用水处理的一种新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是( )
A.Na2FeO4在溶液中显强酸性,能消毒杀菌
B.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C.Na2FeO4的氧化产物Fe3+水解为 Fe(OH)3胶体,可使水中悬浮物凝聚沉降
D.Na2FeO4的还原产物Fe2+水解为Fe(OH)2胶体,可使水中悬浮物凝聚沉降
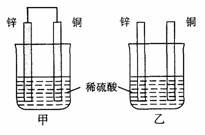 3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是(
)
3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是(
)
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
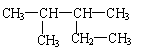 4.对于有机物
的命名正确的是( )
4.对于有机物
的命名正确的是( )
A.2-乙基-3-甲基丁烷 B.2,3-二甲基戊烷
C.2-甲基-3-乙基丁烷 D.3,4-二甲基戊烷
5.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
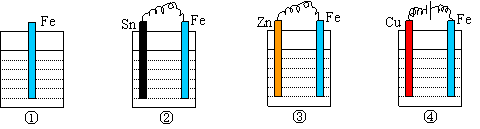 |
A. ④>②>①>③ B.②>①>③>④ C. ④>②>③>① D.③>②>④>①
6.有A、B、C、D四种金属。将A、B用导线联结起来浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.D、C、A、B B.D、A、B、C C.D、B、A、C D.B、A、D、C
7.据《光明日报》报道,2003年1月一辆名叫“超越一号”的电动汽车在同济大学的校园中平稳行驶,该车装着“绿色心脏――固体氧化物燃料电池”。该电池是以H2为阳极燃气,空气为阴极助燃气,电解质是传导阴离子的固体氧化物。该电池工作时正极反应式为( )
A.O2 + 2H2O + 4e- ==== 4OH- B.O2 + 4e- ==== 2O2-
C.2H2 + 2O2- -4e- ==== 2H2O D.H2-2e- ==== 2H+
8.某烃的同分异构体只能生成一种一氯代物,该烃的分子式可能是( )
A.C3H8
B.C4H
9.化学工作者把烷烃、烯烃、环烷烃、炔烃……的通式转化成键数的通式,给研究有机物分子中键能大小的规律带来了很大方便。设键数为I,则烷烃中碳原子数跟键数的关系通式为:CnI3n+1,烯烃(视双键为两条单键)、环烷烃中碳原子数跟键数关系的通式为CnI3n,则苯的同系物中碳原子数跟键数关系的通式为( )
A.CnI3n-1
B.CnI3n
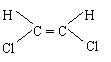 |
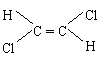 |
10.已知乙烯分子是平面结构,因此,1,2―二氯乙烯可形成 和 两种
不同的空间异构体,称为顺、反异构。下列物质中,能形成类似上述两种空间异构体的是( )
A.1,1―二氯乙烯 B.丙烯 C. 1―丁烯 D.2―戊烯
11.在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+ 几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到
A.加入纯Cu将Fe2+ 还原
B.向溶液中加入(NH4)2S使Fe2+ 沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
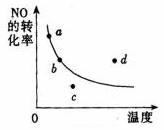 12.图中的曲线是表示其他条件一定时,2NO+O2
12.图中的曲线是表示其他条件一定时,2NO+O2
 2NO2 (正反应 放热)。反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2 (正反应 放热)。反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
A.a点 B.b点
C.c点 D.d点
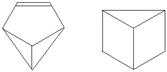
13.近年来科学家利用合成的方法制备了多种与苯组成相同、具有特
殊结构的物质,例如盆烯和棱晶烷。对两种物质论述正确的是( )
A.均为不饱和烃 B.互为同分异构体
C.均属于芳香烃 D.均为高分子化合物
14.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l mol?L-1的盐酸,恰好使混合物完全溶解并放出标准状况下224 mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为( )
A.
15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是( )
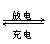 A.放电时负极反应为:Zn-2e- + 2OH- === Zn(OH)2
A.放电时负极反应为:Zn-2e- + 2OH- === Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e- + 5OH- ==== FeO42- + 4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
16.温度为
A.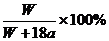 B.
B.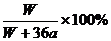 C.
C.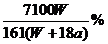 D.
D.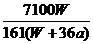 %
%
17、如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。
 |
其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间:Ⅰ>Ⅱ
D.平衡时Ⅰ容器的体积小于V L
第II卷(非选择题,共57分)
二、(本题包括三个小题,共33分)
18.(14分)写出下列各有机物的结构简式:
(1)当0.2mol烃A在O2中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成2,2-二甲基丁烷。则A的结构简式为 ;
(2)某炔烃和H2充分加成后生成2,5-二甲基己烷,则该烃的结构简式为 ;
(3)某烃1mol与2molHCl完全加成,生成的氯代烷最多还可以与4molCl2发生光取代反应,则该烃的结构简式为 ;
(4)分子式为C6H12的某烯烃中所有的碳原子均在同一平面上,则该烃的结构简式为 ;
(5)某烷烃A的蒸汽的密度是相同状况下氢气密度的64倍,经测定得知该分子中共含有6个甲基。
①若A不可能是烯烃与氢气的加成产物,则A的结构简式为 ;
②若A是炔烃与氢气的加成产物,则A的结构简式为 。
 (6)已知烯烃、炔烃,经臭氧作用发生反应:
(6)已知烯烃、炔烃,经臭氧作用发生反应:
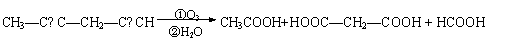 |
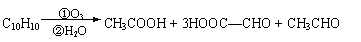 某烃分子式为C10H10,在臭氧作用下可发生如下反应:
某烃分子式为C10H10,在臭氧作用下可发生如下反应:
则C10H10的结构简式为 。
|