
2005年北京市中等学校招生考试
第一卷
一、选择题(共35分,每小题1分。每小题只有一个选项符合题意)
1. 日常生活中发生的下列变化,属于化学变化的是
A. 蜡烛燃烧 B. 纸张粉碎 C. 冰雪融化 D. 酒精挥发
2. 空气中体积分数约占21%的气体是
A. 氮气 B. 氧气 C. 二氧化碳 D. 稀有气体
3. 下列物质中,属于混合物的是
A. 铝 B. 氧化铜 C. 蔗糖水 D. 碳酸钾
4. 用酒精灯给物质加热时,应使用酒精灯火焰的
A. 焰心部分 B. 内焰部分 C. 外焰部分 D. 任何部分
5. 决定元素种类的是原子的
A. 中子数 B. 质子数 C. 电子数 D. 最外层电子数
6. 下列物质中,含有氧分子的是
A. 水 B. 液氧 C. 氧化汞 D. 二氧化碳
7. 下列是一些常用的危险品图标,装运浓硫酸的箱子应贴的图标是
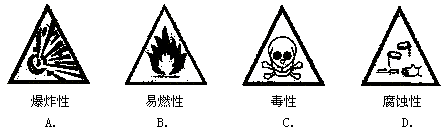
8. 下列符号中,表示两个氮原子的是

9. 下列物质在氧气中燃烧,产生大量白烟的是
A. 木炭 B. 铁丝 C. 氢气 D. 红磷
10. 下列物质的化学式书写不正确的是
A. 氧化镁 MgO2 B. 氧化钠 Na2O
C. 硫酸锌 ZnSO4 D. 氢氧化铜 Cu(OH)2
11. 氮肥能使作物枝叶茂盛,叶色浓绿。下列物质中能用作氮肥的是
A. NH4NO3 B. K2SO4 C. Ca(H2PO4)2 D. NaHCO3
12. 北京市严重缺水,我们要保护好水资源。下列说法中,可能会造成水污染的是
A. 生活污水经处理后排放
B. 禁止含磷洗涤剂的使用
C. 合理使用农药和化肥
D. 在水库周边兴建造纸厂
13. 下列化学反应中,属于化合反应的是
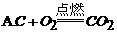
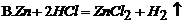
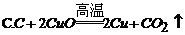
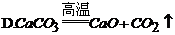
14. 为了减少大气污染,北京市积极推广使用清洁燃料--压缩天然气(CNG)。天然气的主要成分是
A. 甲烷 B. 氧气
C. 氮气 D. 二氧化碳
15. 下列仪器中,量取一定体积的液体时必须用到的是
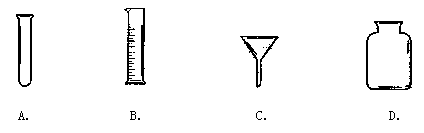
16. 下列物质中,能使无色酚酞试液变红的是
A. 水 B. 稀硫酸 C. 氯化钠溶液 D. 氢氧化钡溶液
17. 常用牙膏的pH范围是8.5~9,对它的酸碱性判断正确的是
A. 呈碱性 B. 呈酸性 C. 呈中性 D. 无法判断
18. 下列关于水的组成,叙述正确的是
A. 水由氢气和氧气组成 B. 水由氢分子和氧原子组成
C. 水由氢元素和氧元素组成 D. 水由两个氢原子和一个氧原子组成
19. 将氢氧化钠溶液滴入下列物质的溶液中,能生成蓝色沉淀的是
A. FeCl3 B. KNO3 C. MgCl2 D. CuSO4
20. 下列物质中,属于氧化物的是
A. SO2 B. Fe(OH)3 C. KClO3 D. NaNO3
21. 下列物质的性质中,属于化学性质的是
A. 胆矾晶体呈蓝色 B. 铁丝能在氧气中燃烧
C. 酒精有特殊气味 D. 氯化钠的熔点是801℃
22. 下列灭火方法中,不正确的是
A. 油锅着火用水浇灭
B. 实验桌上酒精着火用湿布盖灭
C. 白磷着火用沙土盖灭
D. 电器着火切断电源后用湿棉被盖灭
23. 为鉴别氢气、氧气、二氧化碳三瓶气体,可选用的方法是
A. 将水倒入三瓶气体中
B. 将澄清石灰水倒入三瓶气体中
C. 将紫色石蕊试液滴入三瓶气体中
D. 将燃着的木条分别伸入三瓶气体中
24. 手机中使用的锂(Li)电池是新型的高能电池,某种锂电池的总反应可表示为Li+MnO2=LiMnO2。此反应中锂元素的化合价变化为0→+1,下列对锰元素的化合价变化判断正确的是
A. +4→+3 B. +2→+3
C. 0→+2 D. -4→-2
25. 下列化学方程式中,书写正确的是
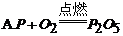
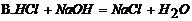
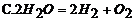
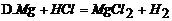
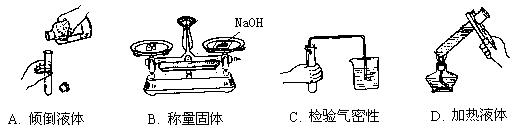
26. 下列图示的化学实验基本操作中,正确的是
27. 下列物质长时间暴露在空气中,会变质的是
A. 木炭 B. 烧碱
C. 浓硫酸 D. 浓盐酸
28. 下列对“20℃时,硝酸钾的溶解度为31.6g”的解释正确的是
A. 20℃时,31.6g硝酸钾溶解在水中
B. 20℃时,100g溶液中含31.6g硝酸钾
C. 31.6g硝酸钾溶解在100g水中达到饱和状态
D. 20℃时,31.6g硝酸钾溶解在100g水中恰好达到饱和状态
29. 用一种试剂鉴别盐酸、氯化钠和氢氧化钙三种溶液,应选用的试剂是
A. 稀硫酸 B. 碳酸钠溶液
C. 氯化钡溶液 D. 氢氧化钾溶液
30. 下列有关铁及其化合物的转化关系中,不能实现的是
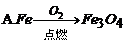
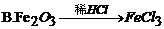
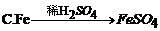
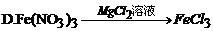
31. 亚硝酸钠(NaNO2)的外观与食盐很相似,有咸味,误食易中毒。区别它们的一种方法是:将两者分别加热到320℃,不分解的是食盐,能分解并放出一种具有刺激性气味气体的是亚硝酸钠。该气体可能是
A. NH3 B. SO2
C. NO2 D. N2
32. 某学生要用实验证明铁、铜、银三种金属的活动性顺序。现有铁片、铜片、硝酸银溶液、稀盐酸四种物质,他设计的下列实验方案中可行的是
A. ①Cu+HCl ②Fe+AgNO3 ③Cu+AgNO3
B. ①Fe+HCl ②Cu+HCl ③Fe+AgNO3
C. ①Fe+HCl ②Fe+AgNO3 ③Cu+AgNO3
D. ①Fe+HCl ②Cu+HCl ③Cu+AgNO3
33. 下列图像与所述实验相符的是
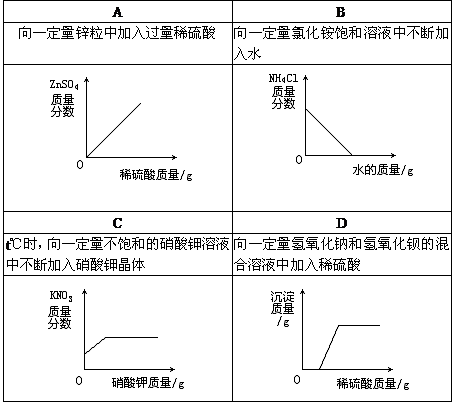
34. 将下列各组中的物质混合,若每组中最后一种物质过量,充分反应后过滤,则滤纸上仅留下一种不溶物(纯净物)的是
①NaOH溶液、MgCl2溶液、硝酸
②BaCl2溶液、NaNO3溶液、稀硫酸
③CuCl2溶液、FeCl2溶液、锌粒
④NaCl溶液、AgNO3溶液、盐酸
⑤Fe2(SO4)3溶液、NaNO3溶液、Ba(OH)2溶液
A. ①④ B. ②③
C. ③⑤ D. ②④
35. 如下图所示装置进行实验(图中铁架台等仪器均已略去)。在I中加入试剂后,塞紧橡皮塞,立即打开止水夹。II中有气泡冒出;一段时间后关闭止水夹,II中液面上升,溶液由无色变为浑浊。符合以上实验现象的I和II中应加入的试剂是
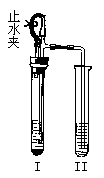
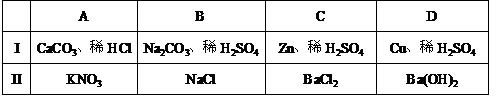
第二卷
二、填空题(共22分)
36. (7分)
(1)某元素的原子结构示意图为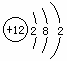 ,该元素原子核内有__________个质子,最外电子层上有__________个电子。
,该元素原子核内有__________个质子,最外电子层上有__________个电子。
(2)用符号表示:2个氢气分子__________;1个氢氧根离子__________。
(3)最近,科学家研究发现,某些食品中使用的苏丹红I号可能致癌。苏丹红I号的化学式为C16H12N2O,它的一个分子中共含有__________个原子,它是由__________种元素组成的,其中氮、氧元素的质量比为__________。
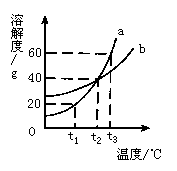
37. (3分)(1)下图为a、b两种固体物质的溶解度曲线。根据该图可知,在t3℃时,a物质的溶解度是__________g;在__________℃时,a和b物质的溶解度相等。
(2)溶质的质量分数为5%~50%的葡萄糖溶液可作为注射营养液。若用10g葡萄糖配制10%的葡萄糖溶液,需加入水__________g。
38. (5分)
(1)在熟石灰、干冰、氢气三种物质中,可用作高能燃料的是__________,可用作致冷剂的是__________,可用于改良酸性土壤的是__________。
(2)制作松花蛋的主要配料有生石灰、草木灰(主要成分是碳酸钾)、食盐等,用水调制配料过程中,可能发生反应的化学方程式为______________________________,______________________________。
39. (5分)为了除去食盐(主要成分为NaCl)样品中含有少量的氯化镁和硫酸钠杂质,某学生根据氯碱工业中精制食盐水的基本原理,运用所学知识设计了如下图所示的①至⑤步除杂方案:
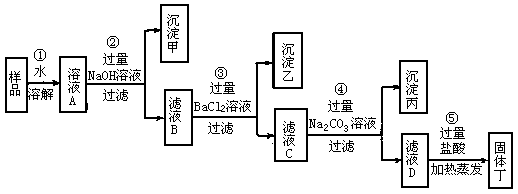
请根据上述除杂方案,回答下列问题:
(1)沉淀甲是__________;滤液C中的溶质是____________________;操作⑤中加入过量盐酸的作用是______________________________。
(2)假设整个操作过程中物质转化无损失,则固体丁中NaCl的质量比原样品中NaCl的质量__________(填增大、不变或减小);若在操作②中改为加过量的KOH溶液,固体丁中可能含有的杂质是__________。
40. (2分)有A、B、C、D、E、F六种物质的稀溶液,已知它们分别是K2CO3、BaCl2、Ca(NO3)2、NaCl、H2SO4、AgNO3中的某一种溶液。下图为常温时上述溶液两两混合的部分实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物。
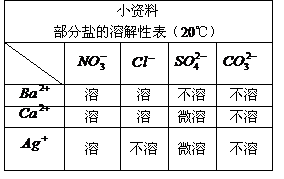
请回答下列问题:
(1)在下图中的空格内用“↓”“↑”“-”表示出对应反应的实验现象。
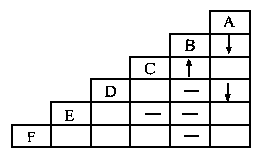
(2)F是__________。
三、实验题(共15分)
41. (6分)根据下列实验装置图,回答问题:
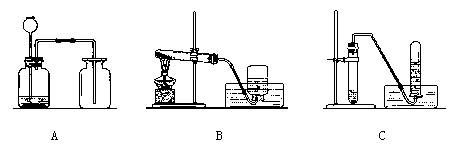
(1)实验室制取二氧化碳常用的药品是__________________,应选用的装置是___________(填装置代号),选用这种收集方法的原因是______________________。
 2KCl+3O2↑),应选用的装置是____________(填装置代号);欲从完全分解后的残渣中回收二氧化锰(难溶于水),其操作步骤是:溶解、___________、烘干;若用向上排空气法收集氧气,检验是否收集满的方法是:将带火星的木条放在____________,观察木条是否复燃。
2KCl+3O2↑),应选用的装置是____________(填装置代号);欲从完全分解后的残渣中回收二氧化锰(难溶于水),其操作步骤是:溶解、___________、烘干;若用向上排空气法收集氧气,检验是否收集满的方法是:将带火星的木条放在____________,观察木条是否复燃。
42. (4分)正确连接如下图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。
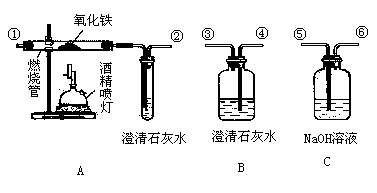
小资料:
☆通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。
☆酒精喷灯可作高温热源。
请回答下列问题:
(1)连接装置导管口的顺序:混合气体→____________→尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是________________________;证明CO存在的有关反应的化学方程式是____________________________________,____________
____________________________________。
43. (5分)有A、B、C、D四瓶失去标签的白色粉末(均为纯净物),已知它们可能是硫酸铜、碳酸钙、氯化钾、硫酸钾中的一种。某学生的鉴别实验过程记录如下:
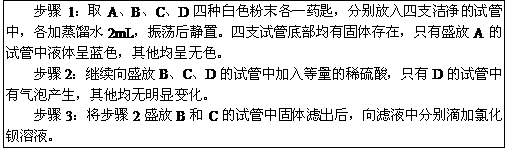
请根据该学生的实验过程,回答下列问题:
(1)步骤1中“四支试管底部均有固体存在”,与该学生预测的“只有一支试管中有固体存在,其他试管中均为澄清溶液”的现象不同,其原因可能是____________________
_______________________________________________________。
(2)步骤3中,可能观察到的实验现象是_________________________________。
(3)根据该学生的实验,请选择下列①或②中的一个问题回答:
①四种白色粉末均已一一鉴别出来,分别是_________________________________
_________________________________(写代号用其对应物质的化学式)。
②四种白色粉末只能部分被鉴别出来,分别是______________________(写代号及其对应物质的化学式);对尚未鉴别出来的物质,请设计实验进行确定,并填写下表。

四、计算题(共8分,最后结果保留1位小数)
44. (4分)为了测定实验室中高锰酸钾样品的纯度(杂质不参加反应),取16g该样品加热,完全反应后,得到1.6g氧气,求样品中高锰酸钾的质量分数。
45. (4分)将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如下图所示。
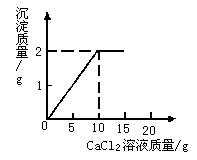
请根据题意计算:
(1)CaCl2溶液与Na2CO3溶液中溶质的质量分数之比。
(2)将反应后的物质过滤,蒸干滤液后得到固体的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com