
2006-2007学年度泰安市上学期期末会考初三化学试题
注意事项:
1.答卷前将密封线内的项目填写清楚。
2.本试题共6页,满分50分,考试时间50分钟。
3.试题中可能涉及的相对原子质量:H:1 C:12 O:16 Cl:35.5 Ca:40
一、选择题(本题包括10小题。1―5题每小题1分。6―10题每小题2分.共15分。每小题只有一个选项符合题意。请将符合题意的选项序号涂在答题卡上)
1.举重运动员在举杠铃前常用“镁粉”搓手,这种“镁粉”的主要成分是MgCO2,它属于
A.单质 B.氧化物 C.碱 D.盐
2.以二氧化锡(Sn02)为敏感材料制成的“气一电”转换器,可用于对有害气体的监测。SnO2中Sn的化合价为
A.一4 B.+4 C.+3 D.+2
3.在过滤实验中,下列操作不恰当的是
A.滤液低于滤纸上边缘
B.用玻璃棒引流液体注入漏斗
C.用玻璃棒搅拌漏斗中的悬浊液,加快过滤速度
D.漏斗下端紧贴在烧杯内壁上
4.酸与碱发生的中和反应在工农业生产和日常生活中有着广泛的应用。下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.服用含Mg(OH)2的药物治疗胃酸过多
C.用NaOH溶液洗涤石油产品中的残余硫酸
D.用盐酸清洗铁丝表面的铁锈
5.人类的第二杀手一心脑血管疾病,给人们的身心健康造成极大的危害。这类疾病患者大多数属于酸性体质,应经常食用碱性食品。根据下表中的信息,这类患者应经常食用的食物为:
A.葡萄 B.牛奶 C.豆制品 D.苹果
6.实验证明点燃的镁条在CO2气体中可以燃烧,生成氧化镁和炭黑(碳单质)。下列说法错误的是
A.金属镁着火不能用C02灭火器灭火
B.镁在二氧化碳中燃烧的化学方程式为2Mg+CO2=2MgO+C
C.镁条在空气中燃烧时只与C02发生了化学反应
D.不是一切物质的燃烧都要在空气或氧气中才能进行
7.物质X是一种重要的阻燃剂。工业上用三氧化二锑(Sb202)生产X的化学方程式为Sb2O3+2H202=X+2H2O2。根据质量守恒定律,推则X的化学式为
A.Sb02 B Sb205 C.HSb03 D.H3Sb04
8.小辉用托盘天平称量一个烧杯的质量时,无论如何调节天平的平衡螺母,天平都不能平衡,后来他将游砝移到O.2刻度处时,天平达到平衡,然后他将该烧杯放在天平左盘中,在天平右盘中加入了两个10g和一个5g的砝码,又移动游码至O.8刻度处,天平又达到平衡。该烧杯的实际质量为
A.25.2g B.25.6g C.25.8g D.26g
9.要配制100glO%的食盐溶液,实验室现有足量的食盐、足量的水、200g5 9,6的食盐溶液、100g20%的食盐溶液,下列配制方法错误的是
A.将10g食盐溶于90g水中
B.在50g20%的食盐溶液中加入50g水
C.将7g食盐溶予93g5%的食盐溶液中
D.在66.67g5%的食盐溶液中加入33.33g20%的食盐溶液
10.“物质的结构决定性质,物质的性质决定用途”是自然科学的重要思想。过氧化氢是一种常用的杀菌消毒剂,其原因是过氧化氢分子中含有一种叫“过氧基”的结构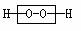 (方框框内部分)。据此推测下列物质中,可作杀菌消毒剂的是
(方框框内部分)。据此推测下列物质中,可作杀菌消毒剂的是
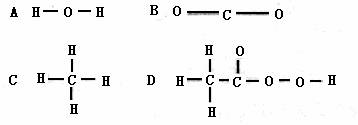
二、(本题包括5小题,共14分)
11.(2分)某原子结构示意图为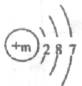 。该图中m表示____,m的值为_____,该原子核外电子层数是_________.在化学反应中该原子容易____电子 (填“得到”或“失去”)。
。该图中m表示____,m的值为_____,该原子核外电子层数是_________.在化学反应中该原子容易____电子 (填“得到”或“失去”)。
12.(2分)按要求写出下列化学符号:
①两个氢原子____________.
③3个钠离子____________.
②4个二氧化硫分子____________.
④水中氧元素的化合价为-2价____________.
13.(3分)把A、B、C、D四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质的质量如下表:
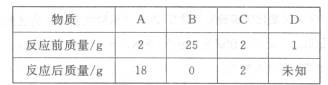
回答下列问题:
(1)反应后D的质量是____________.
(2)C物质可能是____,(填写反应物、生成物或催化剂);
(3)容器中发生反应的反应类是_____(填写基本反应类型)。
14.(2分)将一根生锈的铁钉放人足量的稀盐酸中,开始观察到铁锈逐渐溶解,溶液逐步呈黄色,其反应的化学方程式为.___________过一会又观察到铁钉表面有气泡放出,其反应的化学方程式为_______________.
15.(5分)A、B、C、D、E都是初中化学中的常见物质,相互之间存在以下转化关系。其中A是一种钠盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业。(注:A与B生成C和D的反应属于复分解反应)
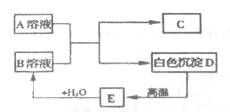
(1)写出下列物质的化学式:
(2)写出下列变化的化学方程式:
①A:____________________;②B:______________________;③C:____________________
A+B→C+D:___________________________.
E→B:___________________________.
三、(本题包括2小题。共14分)
16.(9分)今天又是化学实验室开放日,老师拿出两瓶无标签的试剂,一瓶是固体,一瓶是液体,他分别取少量试剂在试管中混合,立即产生了一种无色气体。
(1)探究此气体是什么物质:
①此气体可能是___________(填一种即可)。
②验证该气体的实验方案为:
(2)探究此气体的制取:
①上述反应生成此气体的化学方程式为:_________________.
②实验室要制取此气体,反应装置可选取下图I中的___________.装置(填序号)。
③实验室要收集此气体,收集装置可选取下图I中的_________装置(填序号)。
④用下图Ⅱ收集该气体时,气体要从由__________端(填“a”或“b”)导入。
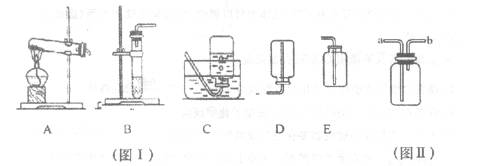
(3)拓展联想:
①上述反应生成的气体还可能是_______________.(填一种即可);
②其反应的化学方程式为_____________________.
17.(5分)小明、小亮和小芳三位同学在一起探究蜡烛燃烧。他们将短玻璃导管插入焰心,在导管的另一端进行点燃,发现另一端也可以燃烧。
(1)提出问题:导管里一定有可燃性气体,气体的成分可能是什么?
(2)猜想:小明认为可能是蜡烛不完全燃烧时产生的CO气体(CO具有可燃烧性,其反应的化学方程式为: );小亮认为可能是蜡烛受热后产生的蜡烛蒸汽小芳认为可能上述两种情况都有。
);小亮认为可能是蜡烛受热后产生的蜡烛蒸汽小芳认为可能上述两种情况都有。
(3)设计实验方案:请你帮助他们设计一个简单的实验方案,来验证哪一种猜想是正确的。
(4)现象与结论:
①如果小明的猜想正确,现象应该是__________________.
②如果小亮的猜想正确,现象应该是__________________.
③如果小芳的猜想正确,现象应该是_____________________.
四、(本题包括2小题,共7分)
18.(2分)莽草酸是从香料八角中提取的一种化合物,用于合成抵抗禽流感的药物“达菲”。已知该物质的化学式为C7H10O5。试根据化学式填空:
(1)该物质中氢、氧二种元素的质量比为_______.
(2)该物质中氧元素的质量分数为____________.
19.(5分)已知石灰石中的杂质既不溶于水,又不与酸反应,高温时也不分解。为了测定石灰石中碳酸钙的质量分数,化学兴趣小组的同学取用了
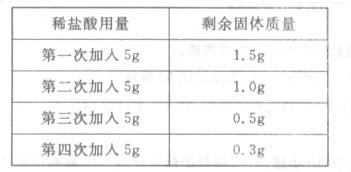
计算:
(1)该石灰石样品中碳酸钙的质量分数。
(2)所用稀盐酸中溶质质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com